Анаплазмоз кошек и собак
Anaplasma phagocytophilum
Anaplasma platys
Читать статью через ВКонтакте
Дата публикации 14.03.2024
Анаплазмозы кошек и собак – трансмиссивные заболевания, возбудителями которых являются бактерии Anaplasma phagocytophilum (гранулоцитарный анаплазмоз) и Anaplasma platys (инфекционная циклическая тромбоцитопения) семейства Anaplasmataceae.
Помимо собак и кошек Anaplasma phagocytophilum также была обнаружена у человека, крупного и мелкого рогатого скота, грызунов, оленей, птиц и других млекопитающих. Anaplasma platys была описана у кабанов, лисиц, оленей, верблюдов, крупного рогатого скота и человека [1, c. 5–6; 2, c. 549].
Историческая справка
Возбудитель гранулоцитарного анаплазмоза впервые был описан Gordon et al. в 1940 году в Шотландии как этиологический агент клещевой лихорадки у овец и был отнесен к классу Rickettsia. В дальнейшем в 1951 году возбудитель получил название Rickettsia phagocytophila, а в 1974 году был переименован в Ehrlichia phagocytophila. В 2001 году была предложена реклассификация рода Ehrlichia и группа возбудителей, включающая E. phagocytophila, E. equi и агента, вызывающего гранулоцитарный эрлихиоз человека, получила название Anaplasma phagocytophilum [3, c. 1–2].
У собак данный возбудитель был впервые обнаружен в 1982 году в Калифорнии. Первый случай заражения кошек описан в Швеции в 1999 [1, c. 1; 4, c. 428].
Возбудитель тромбоцитарного анаплазмоза (инфекционной циклической тромбоцитопении) впервые был описан в 1978 году у собак Harvey et al. в США (Флорида) как риккетсия-подобный организм. На основании морфологии и серологических перекрестных реакций с Ehrlichia canis в 1983 было предложено название Ehrlichia platys. При реклассификации в 2001 году организм получил название Anaplasma platys. У кошек ДНК данного агента была обнаружена в 2010 году в Бразилии [1, c. 1; 2, c. 542–549; 5, c. 1].
Возбудитель
Анаплазмы, поражающие собак и кошек, (род Anaplasma, семейство Anaplasmataceae, порядок Rickettsiales) представляют собой внутриклеточные облигатные плеоморфные грамотрицательные бактерии, преимущественно поражающие лейкоциты (гранулоциты) и тромбоциты, образуя внутриплазматические скопления бактерий – морулы [6, c. 903].
У представителей семейства Anaplasmataceae отсутствует клеточная стенка, а также пептидогликановый слой и липополисахариды (ЛПС), что делает их зависимыми от холестерина хозяина, но позволяет возбудителям тесно связываться внутри клеточных включений, а также избегать иммунного ответа хозяина (рецепторы, экспрессируемые нейтрофилами или макрофагами для обнаружения патогенов, идентифицирующие молекулы пептидогликана и ЛПС, в данном случае их не обнаруживают) [2, c. 542; 7, c. 4].
Основными переносчиками возбудителя гранулоцитарного анаплазмоза A. phagocytophilum являются клещи рода Ixodes. Личинки инфицируются при питании кровью зараженных мелких млекопитающих. После зимовки они линяют в нимф и питаются более крупными млекопитающими. В конце лета - начале осени происходит финальная линька до взрослой особи, питание и спаривание на крупных млекопитающих, после чего самки откладывают яйца на земле и погибают. В клещах анаплазмы мигрируют из средней кишки в слюнные железы и заражают млекопитающих во время питания кровью через слюнные выделения. Сохранение возбудителя на протяжении всех стадий развития клеща обусловлено трансфазной передачей [2, c. 542–544; 8, c. 4–5].
Для A. platys вероятным переносчиком является Rhipicephalus sanguineus s.l. ДНК возбудителя, а также его трансфазная передача была описана в клещах данного вида, однако экспериментально не была доказана передача позвоночным животным [2, c. 549].
Для анаплазм характерен двухфазный биологический цикл с чередованием малой инфекционной формы с плотным ядром (DC – dense-cored cells, 0,2–0,4 мкм) и более крупной неинфекционной бинарно реплицирующийся ретикулярной клеточной формой (RC – reticulatecells, 0,8–2 мкм). Формы DC прикрепляются к поверхности клеток-мишеней хозяина, проникают в них путем эндоцитоза и дифференцируются в неинфекционные RC внутри вакуоли клетки, где бинарно делятся, образуя морулы (1,5–6 мкм). Через несколько дней бактерии редеферренцируются в DC и высвобождаются из клетки путем экзоцитоза или клеточного лизиса, инициируя новый инфекционный цикл [2, c. 542; 9, c.172; 10, c. 5; 14, c. 2; 16, c. 240].
Эпизоотологические данные
Распространение возбудителей напрямую связано с географическим распространением их переносчиков. Данные о мировом распространении, видах клещей-переносчиков, а также позвоночных, подверженных развитию заболевания, указаны ниже в таблице 1. Заражение регистрируется в весенне-осенний период, что связано с сезонной активностью клещей. Основными резервуарами для A. phagocytophilum выступают грызуны и дикие жвачные. Потенциальные резервуары для A. platys – лисы, олени, крупный рогатый скот, кабаны, верблюды [1, c. 4; 2, c. 542–543; 4, c. 428].
Таблица 1. Данные о распространении возбудителей A. phagocytophilum и A. platys, их векторах и позвоночных животных, подверженных развитию заболевания [2, c. 542]
|
Возбудитель |
Основной вектор |
Распространение |
Позвоночные хозяева, подверженные развитию заболевания |
|
A. phagocytophilum |
Ixodes pacificus Ixodes scapularis Ixodes ricinus Ixodes persulcatus |
Северная и Южная Америка, Европа, Азия, Африка |
Лошади, домашний скот, кошки, собаки, человек, верблюды |
|
A. platys |
Rhipicephalus sanguineus s.l.* |
Северная и Южная Америка, Австралия, Европа, Африка, Азия, Ближний Восток |
Собаки, кошки |
На территории нашей страны основными переносчиками A. phagocytophilum являются клещи Ixodes ricinus (западная часть нозоареала) и Ixodesper sulcatus (восточная часть нозоареала) – европейская часть России, Урал, Сибирь и Дальний Восток. Rhipicephalus sanguineus и A. platys – юго-западные регионы страны [11; 12; 13].
Половой, породной и возрастной предрасположенности к заболеванию не было отмечено. Возможна передача возбудителя трансфузионно [1, c. 5–6; 4, c. 429]. Доказана вертикальная передача A. platys от сук потомству в первой половине беременности [2, c 549].
Патогенез и клинические признаки
Наиболее распространенные клинические проявления анаплазмозов у кошек и собак неспецифичны [1, c. 7].
A. phagocytophilum
Передача A. phagocytophilum от переносчика к животному составляет 24–48 часов, бактериемия развивается через 4–7 дней после укуса клеща. Инкубационный период составляет 7–14 дней. Попадая в гранулоциты возбудители ингибируют их функции, такие как фагоцитоз, подвижность, высвобождение активных радикалов кислорода, взаимодействие с эндотелиальными клетками и трансмиграцию нейтрофилов в ткани, а также задерживают их апоптоз. Инфицированию могут быть подвергнуты клетки костного мозга, эндотелиальные клетки и мегакариоциты [1, c. 6; 2, c. 544–545; 14, c. 8].
Тяжесть заболевания варьируется от субклинической до острой формы. Наличие персистенции и хронических проявлений является спорным и может зависеть от штамма возбудителя и иммунного ответа животного. Развивается лимфаденопатия и спленомегалия в результате реактивной лимфоидной гиперплазии и одновременного экстрамедуллярного кроветворения в селезенке. Отмечается тромбоцитопения от легкой до тяжелой, в том числе иммуноопосредованная. Как следствие вторичного иммуноопосредованного (нейтрофильного) артрита можно наблюдать хромоту [1, c. 7;.2, c. 544–545;14, c. 10].
Большинство животных не проявляет клинических признаков, у некоторых развивается самокупирующееся лихорадочное состояние. Помимо лихорадки часто отмечаются слабость, отказ от еды, обезвоживание, лимфаденомегалия, спленомегалия, тахипноэ. Также можно наблюдать бледность слизистых, гепатомегалию, легочные шумы, рвоту, диарею, боль в животе и конечностях, хромоту, нежелание двигаться, петехии, мелена, эпистаксис, коллапс, легкий кашель, увеит, инъекцию склеры у собак и конъюнктивит у кошек, полиурию/полидипсию, неврологические проявления, периферические отеки. По результатам лабораторных исследований наиболее часто регистрируют тромбоцитопению, также можно наблюдать лимфопению, лимфоцитоз, анемию, нейтрофилию, нейтропению, моноцитопению, моноцитоз, эозинофилию, гипоальбуминемию, гиперглобулинемию, умеренную билирубинемию, повышение АЛТ и ЩФ, гипо-/гиперкалиемию, гипо-/гипернатриемию, метаболический ацидоз, нейтрофильное воспаление при исследовании синовиальной жидкости, изостенурию, гипостенурию, протеинурию и повышение соотношения белок/креатинин [1, c. 7-8;2, c. 544-545; 4, c. 432-435].
A. platys
Инкубационный период при заражении A. platys составляет также 7–14 дней, возбудители поражают тромбоциты, после чего можно наблюдать циклические периоды тромбоцитопении (каждые 1–2 недели). Тяжесть тромбоцитопении и процент инфицированных тромбоцитов максимальны в течение первого цикла. Тромбоцитопения в начале заболевания обусловлена прямым механическим повреждением возбудителями, однако в дальнейшем главная роль отводится иммуноопосредованным механизмам. Фракция инфицированных тромбоцитов резко снижается при последовательных паразитемиях, однако эпизоды тромбоцитопении остаются тяжелыми. Хроническая инфекция обусловлена низкой бактериемией и легкой тромбоцитопенией. В некоторых исследованиях было описано обнаружение возбудителя в мегакариоцитах [1, c. 7–9; 5, c. 1; 15, c. 449].
Клиническая картина у собак зависит от штамма возбудителя, наличия сопутствующих инфекций и иммунного ответа животного. Часто модно наблюдать лихорадку, вялость, анорексию, потерю веса, бледность слизистых оболочек, петехии, истечения из носа, лимфаденопатию, реже увеит и эпистаксис, спленомегалию, поражения глаз, гифему, экхимозы, обезвоживание, нарушения опорно-двигательного аппарата и, возможно, кожные поражения. По результатам лабораторных исследований: тромбоцитопения, нерегенеративная анемия, гипоальбуминемия, гиперглобулинемия. У кошек в единичных отчетах при выявлении ДНК возбудителя среди описанных клинических признаков была отмечена тромбоцитопения, у одного животного наблюдали анорексию [1, c. 8;2, c. 549–550].
Часто описаны ко-инфекции c Borrelia burgdorferi, Ehrlichia canis, Babesia spp., а также с другими трансмиссивными патогенами [1; c. 7, 11].
Диагностика
Существует несколько лабораторных методов для диагностики анаплазмоза.
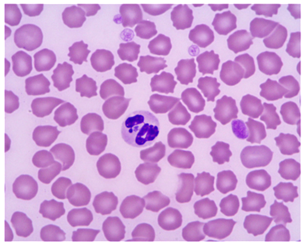
Микроскопия – обнаружение морул при исследовании мазка крови (рис.1, 2). Морулы A. phagocytophilum обнаруживали в крови на 4 день после экспериментального заражения и они сохранялись в течение 4–8 дней. Морулы A. platys обнаруживали на 8–15 день. Метод обладает низкой чувствительностью, а также не позволяет дифференцировать A. phagocytophilum от Ehrlichia ewingii [1, c. 8–9; 2, c. 545–551].
Серологические методы диагностики для обнаружения антител. Материал для исследования – сыворотка крови. При экспериментальном заражении антитела к A. phagocytophilum были обнаружены спустя 8 дней после заражения, к A.platys – через 16 дней. Рекомендовано комбинировать с ПЦР для лучшей интерпретации результатов.
Недостатки серологических методов:
— положительный результат указывает на наличие контакта с возбудителем, но не представляют информации об активности инфекции;
— присутствует перекрестная реактивность между A. phagocytophilum и A. platys, реже между A. phagocytophilum и E. canis, A. platys и E. canis;
— возможны ложноотрицательные результаты на ранних стадиях заболевания [1, c. 9–10; 2, c. 546–551].
Молекулярные методы исследования – ПЦР. Является наиболее чувствительным и специфичным методом диагностики, позволяет выявить возбудителя до появления морул в мазках крови и обнаружения антител. Материалы для исследования: венозная кровь, лейкоцитарная пленка, костный мозг, аспираты селезенки и лимфатических узлов. Обнаружение ДНК возбудителя следует рассматривать как свидетельство активной инфекции. Исследовать биоматериал методом ПЦР следует до применения антибиотиков во избежание ложноотрицательных результатов [1, c. 9–10; 2, c. 546–551].
Рис. 1. Морулы A.platys в тромбоците [1, с. 9]
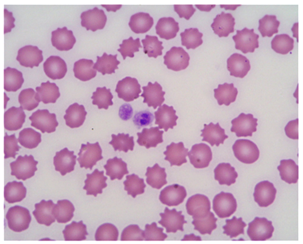
Рис.2. Морулы A. phagocytophilum в цитоплазме нейтрофила [1, с. 9]
Перекрестная реактивность при серологических методах исследования между A. phagocytophilum и A. platys, а также использование тест-систем ПЦР без дифференцирования видов может представлять проблему для дифференциальной диагностики в случае, если оба возбудителя присутствуют в одном и том же регионе, однако лечение у обоих видов анаплазмоза схожее [2, c.547-551].
Список литературы
1. Sainz Á, Roura X, Miró G, et al. Guideline for veterinary practitioners on canine ehrlichiosis and anaplasmosis in Europe. Parasit Vectors. 2015;8:75. Published 2015 Feb 4. doi:10.1186/s13071-015-0649-0
2. Granick, J., Lappin, M. R., Waner, T., Harrus, S., & Mylonakis, M. E. Anaplasmosis. InGreene’s Infectious Diseases of the Dog and Cat, 5th ed.; Sykes, J.E., Ed.; Elsevier: St Louis,MO, 2023 (pp. 542-554).
3. Stuen S, Granquist EG, Silaghi C. Anaplasma phagocytophilum--a widespread multi-host pathogen with highly adaptive strategies. Front Cell Infect Microbiol. 2013;3:31. Published 2013 Jul 22. doi:10.3389/fcimb.2013.00031
4. Schäfer I, Kohn B. Anaplasma phagocytophilum infection in cats: A literature review to raise clinical awareness. J Feline Med Surg. 2020;22(5):428-441. doi:10.1177/1098612X20917600
5. Dyachenko V, Pantchev N, Balzer HJ, Meyersen A, Straubinger RK. First case of Anaplasma platys infection in a dog from Croatia. Parasit Vectors. 2012;5:49. Published 2012 Mar 9. doi:10.1186/1756-3305-5-49
6. Vissotto de Paiva Diniz, P. P. (2020). Ehrlichiosis and anaplasmosis. Clinical small animal internal medicine, 903-912.
7. Torina A, Villari S, Blanda V, et al. Innate Immune Response to Tick-Borne Pathogens: Cellular and Molecular Mechanisms Induced in the Hosts. Int J Mol Sci. 2020;21(15):5437. Published 2020 Jul 30. doi:10.3390/ijms21155437
8. Alberdi P, Espinosa PJ, Cabezas-Cruz A, de la Fuente J. Anaplasma phagocytophilum Manipulates Host Cell Apoptosis by Different Mechanisms to Establish Infection. Vet Sci. 2016;3(3):15. Published 2016 Jul 15. doi:10.3390/vetsci3030015
9. Moumène A, Meyer DF. Ehrlichia's molecular tricks to manipulate their host cells. Microbes Infect. 2016;18(3):172-179. doi:10.1016/j.micinf.2015.11.001
10. Colonne PM, Winchell CG, Voth DE. Hijacking Host Cell Highways: Manipulation of the Host Actin Cytoskeleton by Obligate Intracellular Bacterial Pathogens. Front Cell Infect Microbiol. 2016;6:107. Published 2016 Sep 22. doi:10.3389/fcimb.2016.00107
11. Masuzawa T, Kharitonenkov IG, Okamoto Y, Fukui T, Ohashi N. Prevalence of Anaplasma phagocytophilum and its coinfection with Borrelia afzelii in Ixodes ricinus and Ixodes persulcatus ticks inhabiting Tver Province (Russia) - a sympatric region for both tick species. J Med Microbiol. 2008;57(Pt 8):986-991. doi:10.1099/jmm.0.47721-0
12. Livanova NN, Fomenko NV, Akimov IA, et al. Dog survey in Russian veterinary hospitals: tick identification and molecular detection of tick-borne pathogens. Parasit Vectors. 2018;11(1):591. Published 2018 Nov 14. doi:10.1186/s13071-018-3161-5
13. Волгина Наталия Сергеевна, Олейник Вера Владимировна, Зырянова Александра Викторовна, Пыхова Лаура Сергеевна, Енгашев Сергей Владимирович, & Прилепский Юрий Олегович (2022). ВЕКТОРНЫЕ ЗАБОЛЕВАНИЯ У СОБАК В ЧЕРНОМОРСКОМ РЕГИОНЕ РОССИИ (Г. СОЧИ): НОВЫЕ ДАННЫЕ. Российский ветеринарный журнал, (2), 5-16.
14. El Hamiani Khatat S, Daminet S, Duchateau L, Elhachimi L, Kachani M, Sahibi H. Epidemiological and Clinicopathological Features of Anaplasma phagocytophilum Infection in Dogs: A Systematic Review. Front Vet Sci. 2021;8:686644. Published 2021 Jun 23. doi:10.3389/fvets.2021.686644
15. Baker DC, Simpson M, Gaunt SD, Corstvet RE. Acute Ehrlichia platys infection in the dog. Vet Pathol. 1987;24(5):449-453. doi:10.1177/030098588702400513
16. Popov VL, Han VC, Chen SM, et al. Ultrastructural differentiation of the genogroups in the genus Ehrlichia. J Med Microbiol. 1998;47(3):235-251. doi:10.1099/00222615-47-3-235
