Американский гнилец пчел
American Foulbrood
Читать статью через ВКонтакте
Дата публикации: 09.07.2020
Аннотация
Пчелы относятся к числу наиболее важных продуктивных видов животных (Morse and Calderon, 2000), и тем не менее, их поражают многочисленные патогены: вирусы, бактерии, грибки и паразиты, которые представляют серьезную угрозу их здоровью. Ввиду жизненно важной роли, которую медоносные пчелы играют в опылении сельскохозяйственных культур, фруктов и полевых цветов, факторы, влияющие на здоровье пчел, также влияют и на стабильность и прибыльность предприятий сельского хозяйства, а также на многие несельскохозяйственные экосистемы (Pernal et al., 2008; von der Ohe, 2003).
До описания паразитического клеща Varroa destructor, наиболее важными с экономической точки зрения болезнями медоносных пчел считались бактериальные болезни расплода: европейский гнилец (European Foulbrood, EFB) и американский гнилец (American Foulbrood, AFB). AFB по-прежнему является одной из самых вредоносных болезней пчел. Это очень заразное заболевание и его распространению способствуют обмен ульями и пчелиным материалом, содержание большого количества ульев в замкнутом пространстве, торговля пчелиными матками, семьями и медом.
Во многих странах AFB является заболеванием, подлежащим регистрации, и контроль за ним регулируется соответствующими законами. Сжигание колоний и ульев зачастую считается единственно осуществимой мерой контроля за больными семьями; в то же время перегон (переселение) пчелиной семьи в новый улей (т.н. the shook swarm или shakedown method) иногда применяется для дезинфекции зараженных, хотя еще не клинически больных семей (Pernal et al., 2008; von der Ohe, 2003).
Патогенез
Американский гнилец (American Foulbrood, AFB) влияет только на личиночные стадии пчел. Возбудителем AFB является грамположительная, спорообразующая бактерия Paenibacillus larvae (Genersch et al., 2006). Чрезвычайно живучие эндоспоры являются единственной инфекционной формой данного организма. Споры контагиозны только для личинок; взрослые пчелы не заражаются при проглатывании спор P. larvae (Hitchcock et al., 1979; Wilson, 1971). Личинки наиболее восприимчивы к инфекции на ранних стадиях развития – через 12-36 ч после вылупления из яиц. В течение этого временного интервала перорального приема вместе с кормом около десяти спор достаточно для заражения (Bamrick and Rothenbuhler, 1961; Brodsgaard et al., 1998; Genersch et al., 2005; Woodrow, 1942; Woodrow and Holst, 1942).
Проглоченные личинками споры проходят через переднюю кишку и прорастают в средней кишке примерно через 12 ч после приема корма (Bamrick, 1967; Yue et al., 2008). Вегетативные формы бактерий колонизируют среднюю кишку и там массово размножаются без видимого нарушения целостности эпителия средней кишки личинки (Yue et al., 2008).
На этой стадии заражения P. larvae, очевидно, следует комменсальному образу жизни, питаясь кормом, поглощенным личинкой. Это согласуется с ранее полученными данными о том, что P. Larvae содержит активные ферменты, участвующие в углеводном обмене, и что они способны метаболизировать различные сахара, включая глюкозу и фруктозу, для поддержания вегетативного роста (Julian and Bulla, 1971; Neuendorf et al., 2004). У инфицированных личинок перитрофическая мембрана помогает удерживать бактериальную массу в просвете средней кишки несмотря на то, что P. larvaeспособен проникать через данный защитный слой (Davidson, 1970; Yue et al., 2008) и атаковать эпителий на более поздней стадии инфицирования, когда кишка личинки заполнена патогенными бактериями. Нарушение эпителия происходит попарацеллюлярному пути, то есть бактерии, чтобы попасть в схизоцель, сначала попадают в межклеточное пространство.
Одной из особенностей P. larvae является то, что она секретирует высокоактивные внеклеточные протеазы во время вегетативного роста и инфицирования (Dancer and Chantawannakul, 1997; Holst, 1946; Holst and Sturtevant, 1940; Hraba kand Martinek, 2007). Заманчиво было бы предположить, что некоторые из этих протеаз ответственны за нарушение целостности эпителиального барьера, разрушая соединительные структуры клетка-клетка и клетка-матрица, тем самым позволяя P. larvae проникать в схизоцель. Протеазы также необходимы P. larvae для последующей деградации личиночных остатков до коричневатой субстанции вязкой консистенции. Оба процесса жизненно важны для P. larvae, так как она должна каким-то образом избавляться от личиночного покрова, находясь еще в вегетативной стадии, чтобы после споруляции все споры распространились внутри пчелиной семьи и были доступны к проглатыванию следующим хозяином. На этой стадии (рис. 1-3) личинка плотно прилегает к нижней стенке ячейки соты. Данная вязкая субстанция – высокоинфекционная, поскольку содержит миллионы спор (Bailey and Ball, 1991; Gregorc and Bowen, 1998; Lindström et al., 2008a; Sturtevant, 1932). Споры сохраняют способность к заражению на протяжении более чем 35 лет и хорошо переносят высокие и низкие температуры, сквозняки и повышенную влажность (Hasemann, 1961). Именно стойкость спор и образование чрезвычайно большого их количества усложняют контроль над AFB (Schirach, 1769).
 | |
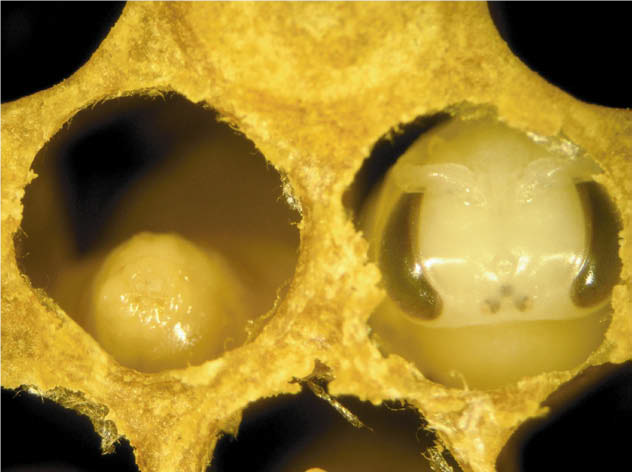
| Рисунок 1. Красный круг – пораженная
P.
larvae куколка. Источник: Genersch E. American Foulbrood in honeybees and its causative agent, Paenibacillus larvae. Journal of Invertebrate Pathology 103 (2010) S10–S19, doi:10.1016/j.jip.2009.06.015 | |
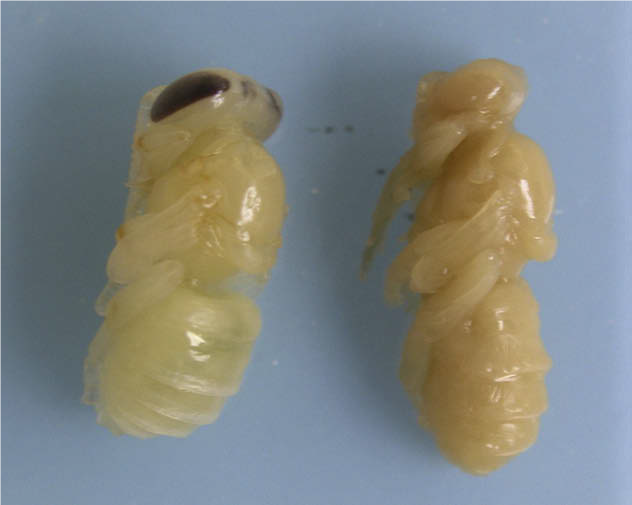 | |
| Рисунок 2. Куколки одного и того же
возраста: здоровая (слева) и больная AFB (справа). Источник: Genersch E. American Foulbrood in honeybees and its causative agent, Paenibacillus larvae. Journal of Invertebrate Pathology 103 (2010) S10–S19, doi:10.1016/j.jip.2009.06.015 | |
 | |
| Рисунок 3. Куколки одного и того же
возраста: здоровая (справа) и больная AFB (слева). Источник: Genersch E. American Foulbrood in honeybees and its causative agent, Paenibacillus larvae. Journal of Invertebrate Pathology 103 (2010) S10–S19, doi:10.1016/j.jip.2009.06.015 |
Классификация Paenibacillus larvae
В 18-м веке P. larvae описывали как возбудителя болезни пчелиного расплода. Данная болезнь характеризовалась неприятным запахом, исходящим от больной колонии, и, как следствие, было придумано название – «Foulbrood» (Schirach, 1769). Более чем через столетие в литературе можно найти первый намек на то, что «гнильец» может включать в себя две разные болезни. Согласно Dzierzon (1882), у «гнильца» две различные этиопатологии: «мягкая и излечимая» форма у незапечатанного расплода (скорее всего, то, что мы сейчас называем европейским гнильцом) и «злокачественная и неизлечимая» форма у запечатанного расплода (почти наверняка это американский гнилец). В 1885 году Bacillus alvei был выделен и идентифицирован как возбудитель болезни в то время еще просто известной как «гнилец» (Cheshire and Cheyne, 1885).
В 1906 году американский микробиолог White не смог изолировать B. Alvei из вязкой массы и вместо этого культивировал в чистой культуре неизвестную бактерию. Основываясь на морфологии и способности образовывать эндоспоры, он классифицировал бактерию, которая постоянно обнаруживалась у больных и мертвых личинок, как Bacillus larvae (White, 1906). Он также был тем, кто первым понял, что существует два разных гнильца, вызванных разными патогенами, вызывающие разные симптомокомплексы. Первый – Европейский гнилец, вызываемый Melissococcus plutonius с B. alvei и/или Enterococcus faecalis в качестве вторичных инфекций (Bailey, 1956, 1957, 1983; Bailey et al., 1973); второй – американский гнилец B. Larvae (White, 1906).
В 1950 году из мертвого расплода медоносной пчелы, высохшего до порошкообразного состояния, была выделена еще одна бактерия, классифицированная как Bacillus pulvifaciens (Katznelson, 1950). В литературе существуют противоречивые сообщения о связи между B. pulvifaciens и так называемым «порошковидным расплодом» личинок пчел (Hitchcock et al., 1979; Katznelson and Jamieson, 1951), и для окончательного ответа в вопросе о патогенности и вирулентности данной бактерии потребовалось более 50 лет (Genersch et al., 2006). При сравнении последовательностей малых субъединиц рРНК (16S рРНК) стало очевидно, что род Bacillus состоит из пяти филогенетических линий (Ash et al., 1991), что потребовало обширного пересмотра таксономии. Одна из этих филогенетических линий легла в основу нового рода – Paenibacillus (Ash et al., 1993) и B. larvae и B. pulvifaciens были отнесены к новому роду и переименованы в Paenibacillus larvae и Paenibacillus pulvifaciens соответственно (Ash et al., 1993). Однако более глубокий анализ с использованием других генных маркеров показал, что разделение на два различных вида не оправдано, что привело к объединению этих двух видов в один – P. larvae (Heyndrickx et al., 1996). На внутривидовом уровне вид P. larvae был классифицирован на два подвида – P. Larvae subsp. larvae и Paenibacillus larvae subsp. pulvifaciens. Причиной были фенотипические и генотипические различия, а также различные патологии, вызываемые этими двумя подвидами (Heyndrickx et al., 1996).
Однако, исследования характеристик штаммов, выделенных от больных семей, противоречили тому, что было указано в обновленных описаниях двух подвидов. Одним из примеров была способность производить оранжевый пигмент, обнаруженный исключительно у P. l. pulvifaciens (Heyndrickx et al., 1996). Было также описано, что два подвида различаются по своей способности утилизировать различные углеводы (Heyndrickx et al., 1996), хотя не все полевые штаммы обладают способностью метаболизировать салицил и маннитол (Carpana et al., 1995; Dobbelaere et al., 2001).
Современные молекулярные методы (Versalovic et al., 1994), примененные к нескольким типовым и эталонным штаммам обоих подвидов и к коллекции полевых штаммов, выделенных из колоний, пораженных AFB в Германии, Швеции и Финляндии (Genersch et al., 2006), в совокупности с классическими методами (морфология колоний, электронно-микроскопический анализ морфологии спор) (Versalovic et al., 1994) подтвердили высокий уровень сходства и не подтвердили положение штамма P. l. pulvifaciens как отдельного подвида. Наконец было подтверждено, что все штаммы, независимо от их принадлежности к одному из подвидов, были патогенными для личинок. Зараженные личинки умирали с признаками AFB, а останки личинок разлагались до характерной вязкой массы. Следовательно, самый сильный аргумент (Heyndrickx et al., 1996) – различия в патологиях P. l. Larvae и P. l. pulvifaciens (Gilliam and Dunham, 1978; Katznelson, 1950; White, 1906) был признан недействительными, что привело к устранению необходимости в делении на подвиды (Genersch et al., 2006).
───── ◉ ─────
В связи с этой довольно частой переклассификацией этиологического агента AFB в литературе можно найти возбудителя как B. larvae (White, 1906), имеющего близкого родственника B. pulvifaciens (Katznelson, 1950); как два отдельных вида P. larvae и P. pulvifaciens (Ash et al., 1993), как два подвида P. l. Larvae и P. l. Pulvifaciens (Heyndrickx et al., 1996) и, наконец, как отдельный вид P. Larvae (Genersch et al., 2006).
Это необходимо учитывать при поиске документов, связанных с AFB, в литературных базах данных. Для тех, кто входит в область исследований AFB после самой последней реклассификации, следует учесть, что обозначения штаммов P. larvae, такие как PLL и PLP (например, Antunez et al., 2007) являются остатками прежней классификации подвидов.
───── ◉ ─────
Вирулентность и трансмиссивность
До настоящего времени AFB считался парадигмой высоковирулентного заболевания пчел, передаваемого горизонтально в т.ч. между семьями (Fries and Camazine, 2001).
Хотя передача P. Larvae между пчелами в пределах одной семьи является исключительно горизонтальной, исходя из полевых наблюдений хорошо известно, что некоторые зараженные семьи оставались сильными и не проявляли клинических симптомов заболевания, что подразумевает возможность возникновения менее вирулентных форм P. Larvae (Hanse nand Brodsgaard, 1999), которые могут передаваться вертикально в процессе репродуктивного роения. И действительно, недавние исследования показали, что AFB передается не только горизонтально, например, из-за болезни, ослабляющей семью, или после разграбления улья (Lindström et al., 2008b), но также и вертикально через роящиеся сильные, хотя и зараженные, пчелиные семьи (Fries et al., 2006).
Данные о различиях в вирулентности генотипов P. larvae у разных пчелосемей (Rauch et al., 2009) также позволяют предположить, что может произойти вертикальная передача возбудителя посредством роения. Однако в данном контексте все еще остается открытым один вопрос: действительно ли роение представляет собой вертикальный путь передачи P. Larvae между семьями или это лекарство, способ вылечиться от болезни? Для успешной вертикальной передачи рой должен нести споры и инфицировать новых личинок, чтобы образовалось еще больше спор, что обеспечило бы выживание патогена в популяции пчел или в окружающей среде. Напротив, для эффективного излечения рой должен быть в состоянии избавиться от спор до заражения следующего расплода, тем самым нарушая развитие болезни и передачу патогена. Вопрос вертикальной передачи AFB был исследован Fries et al. (Fries et al., 2006).
Fries et al. определили количество спор P. larvae в клинически пораженных семьях и в зараженных семьях без видимых клинических симптомов. Они продемонстрировали, что в роях, состоящих из зараженных, хотя еще не явно пораженных пчел (менее 20 бактериальных единиц на пчелу), обнаруживаемый уровень спор резко снижался в течение 2 месяцев после роения и оставался почти необнаруженным в течение более чем 13-ти месяцев. Что указывает на то, что в этих колониях не были заражены личинки, и, следовательно, в этих колониях не образовывались новые споры. Это согласуется с использованием метода перегона пчелиной семьи (the shook swarm или shakedown method) как альтернативного способа борьбы с AFB, демонстрирующем, что перегон является эффективным способом излечения части семьи от AFB (Pernal et al., 2008). Однако, напротив, у роев, происходящих из клинически больных семей, у которых споровая нагрузка составляла приблизительно 6000 бактериальных единиц на пчелу, количество спор снижалось в течение пяти недель после роения, но затем снова увеличивалась до обнаруживаемых уровней через 13 недель, что указывает на образование новых спор. Следовательно, перегон клинически больных семей не имеет лечебного эффекта, тогда как перегон не клинически больных семей позволяет минимизировать риск распространения AFB.
Контроль AFB
Изучение литературы последнего десятилетия показало, что имеется интерес к поиску новых стратегий борьбы с AFB. Поскольку во многих странах данное заболевание подлежит регистрации, меры по борьбе с ним и лечебные мероприятия часто регулируются законом и включают уничтожение клинически инфицированных ульев. В некоторых странах для лечения инфицированных пчелосемей разрешено использовать антибиотики, но в большинстве европейских стран использование антибиотиков при лечении болезней пчел запрещено. В тех странах, где разрешены антибиотики, общей стратегией профилактики и лечения является использование окситетрациклина гидрохлорида (oxytetracycline hydrochloride, OTC) или сульфатиазола (sulfathiazole).
| Однако, имеются проблемы, связанные с длительным использованием антибиотиков: |
| — антибиотики не эффективны против спор, следовательно, они только подавляют клинические признаки и маскируют заболевание, но не могут вылечить пчел от AFB (Lodesani and Costa, 2005; Martel et al., 2006) |
| — в мёде могут сохраняться следы антибиотиков, влияющие на его качество и безопасность (Lodesani and Costa, 2005; Martel et al., 2006) |
| — при скармливании личинкам и взрослым пчелам, антибиотики могут влиять на жизнеспособность расплода и продолжительность жизни пчел (Peng et al., 1992) |
| — у P. larvae стала широко распространенной резистентность к окситетрациклина гидрохлориду (oxytetracycline hydrochloride, OTC) и сульфатиазолу (sulfathiazole) (Evans, 2003; Lodesani and Costa, 2005; Miyagi et al., 2000; Mussen, 2000; Piccini and Zunino, 2001), что говорит о необходимости поисков новых альтернатив лечению антибиотиками (Alippi et al., 2005; Gallardo et al., 2004; Kochansky and Pettis, 2005; Kochansky et al., 2001; Peng et al., 1996; Williams et al., 1998) |
Идея получить медоносных пчел, способных лучше противостоять AFB за счет усиления коллективного иммунного ответа посредством контролируемого разведения, на сегодняшний день уже оказалась успешной. Колонии медоносных пчел, отобранные по гигиеническому поведению на основе анализа с «замороженным расплодом», продемонстрировали устойчивость к AFB (Spivak and Reuter, 2001). В этом анализе учитывается время на обнаружение пчелами, распаковку и удаление мертвого расплода из определенной секции сот, которые были вырезаны из рамки внутри гнезда расплода, заморожены при температуре -20C° в течение 24 часов и помещены в гнездо тестовой колонии (Spivak and Reuter, 1998). Данные результаты по устойчивости к AFB сходились с ранними исследованиями, которые также продемонстрировали, что наиболее важным механизмом устойчивости к AFB является гигиеническое поведение взрослых пчел по отношению к зараженным личинкам (Rothenbuhler, 1964a; Rothenbuhler, 1964b). Полезность таких действий подтверждается и недавним наблюдением о том, что гигиеническое поведение пчел-нянек, выражающееся в обнаружении и удалении больного расплода, оказывает явное влияние на образование новых спор и, следовательно, на передачу и дальнейшее прогрессирование заболевания внутри зараженной семьи (Rauch et al., 2009).
Биоконтроль при помощи антагонистических бактерий так же является заманчивой идеей. Уже были проведены первые успешные эксперименты с культивируемыми P. Larvae (Evans and Armstrong, 2005; Evans and Armstrong, 2006). Тем не менее, одной из особенностей P. larvae является то, что она неизменно выделяется в виде чистой культуры из мертвых личинок AFB (White, 1906), что указывает на то, что сама P. larvae вырабатывает мощные антибиотики (Fünfhaus et al., 2009). Таким образом, эффективность антагонистических бактерий против инфекции P. Larvae in vivo еще предстоит изучить. Эфирные масла, эффективные против P. larvae, также являются многообещающей идеей, тем более что возможна одновременная обработка P. Larvae и клеща V. destructor. Но эффективность такого лечения и отсутствие неблагоприятных побочных эффектов на жизнеспособность пчел (Ebert et al., 2007; Higes et al., 1997) и качество меда все еще нуждаются в оценке на практике.
References
Alippi, A.M., Aguilar, O.M., 1998a. Characterization of isolates of Paenibacillus larvae subsp. Larvae from diverse geographical origin by polymerase chain reaction and BOX primers. J. Invertebr. Pathol. 72, 21–27.
Alippi, A.M., Aguilar, O.M., 1998b. Unique DNA fingerprint patterns of Paenibacillus larvae subsp. Larvae strains. J. Apic. Res. 37, 273–280.
Alippi, A.M., Albo, G.N., Reynaldi, F.J., De Giusti, M.R., 2005. In vitro and in vivo susceptibility of the honeybee bacterial pathogen Paenibacillus larvae subsp. larvae to the antibiotic tylosin. Vet. Microbiol. 109, 47–55.
Alippi, A.M., Lopez, A.C., Aguilar, O.M., 2002. Differentiation of Paenibacillus larvae subsp. larvae, the cause of American foulbrood of honeybees, by using PCR and restriction fragment analysis of genes encoding 16S rRNA. Appl. Environ. Microbiol. 68, 3655–3660.
Alippi, A.M., Lopez, A.C., Aguilar, O.M., 2004a. A PCR-based method that permits specific detection of Paenibacillus larvae subsp. Larvae, the cause of American foulbrood of honey bees, at the subspecies level. Lett. Appl. Microbiol. 39, 25–33.
Alippi, A.M., Reynaldi, F.J., Lopez, A.C., De Giusti, M.R., Aguilar, O.M., 2004b. Molecular epidemiology of Paenibacillus larvae larvae and incidence of American foulbrood in Argentinean honeys from Buenos Aires province. J. Apic. Res. 43, 135–143.
Alippi, A.M., Reynaldi, F.J., 2006. Inhibition of the growth of Paenibacillus larvae, the causal agent of American foulbrood of honeybees, by selected strains of aerobic spore-forming bacteria isolated from apiarian sources. J. Invertebr. Pathol. 91, 141–146.
Antunez, K., Harriet, J., Gende, L., Maggi, M., Eguaras, M., Zunino, P., 2008. Efficacy of natural propolis extract in the control of American foulbrood. Vet. Microbiol. 131, 324–331.
Antunez, K., Piccini, C., Castro-Sowinski, S., Rosado, A.S., Seldin, L., Zunino, P., 2007. Phenotypic and genotypic characterization of Paenibacillus larvae isolates. Vet. Microbiol. 124, 178–183.
Ash, C., Farrow, J.A.E., Wallbanks, S., Collins, M.D., 1991. Phylogenetic heterogeneity of the genus Bacillus revealed by comparative analysis of small subunitribosomal RNA sequences. Lett. Appl. Microbiol. 13, 202–206.
Ash, C., Priest, F.G., Collins, M.D., 1993. Molecular identification of rRNA group 3 bacilli (Ash, Farrow, Wallbanks and Collins) using a PCR probe test. Antonie Van Leeuwenhoek 64, 253–260.
Ashiralieva, A., Fünfhaus, A., Borriss, R., Genersch, E., 2008. Identification of entomocidal toxins in Paenibacillus larvae. Apidologie 39, 599.
Ashiralieva, A., Genersch, E., 2006. Reclassification, genotypes, and virulence of Paenibacillus larvae, the etiological agent of American foulbrood in honeybees – a review. Apidologie 37, 411–420.
Bailey, L., 1956. Aetiology of European foulbrood – disease of the larval honeybee. Nature 178, 1130.
Bailey, L., 1957. The cause of European foulbrood. Bee World 38, 89–95.
Bailey, L., 1983. Melissococcus pluton. The cause of European foulbrood of honeybees (Apis ssp.). J. Appl. Bacteriol. 55, 65–69.
Bailey, L., Ball, B.V., 1991. Honey Bee Pathology. Academic Press, New York, London.
Bailey, L., Fernando, E.F., Stanley, B.H., 1973. Streptococcus faecalis, Bacillus alvei, and sacbrood virus in European foulbrood of honey bee. J. Invertebr. Pathol. 22, 450–453.
Bamrick, J.-F., 1967. Resistance to American foulbrood in honey bees. VI. Spore germination in larvae of different ages. J. Invertebr. Pathol. 9, 30–34.
Bamrick, J.-F., Rothenbuhler, W.C., 1961. Resistance to American foulbrood in honeybees. IV. The relationship between larval age at inoculation and mortality in a resistant and a susceptible line. J. Insect Pathol. 3, 381–390.
Bastos, E.M.A.F., Simone, M., Jorge, D.M., Soares, A.E.E., Spivak, M., 2008. In vitro study of the antimicrobial activity of Brazilian propolis against Paenibacillus larvae. J. Invertebr. Pathol. 97, 273–281.
Benada, O., Drobnikova, V., Kalachova, L., Ludvik, J., 1988. Plasmid DNA in Bacillus larvae. J. Apic. Res. 27, 35–39.
Bodorova-Urgosikova, J., Benada, O., Tichy, P., 1992. Large-scale isolation and partial characterization of plasmid DNA from B. Larvae. Folia Microbiol. 37, 82–86.
Brodsgaard, C.J., Ritter, W., Hansen, H., 1998. Response of in vitro reared honey bee larvae to various doses of Paenibacillus larvae larvae spores. Apidologie 29.
Carpana, E., Marocchi, L., Gelmini, L., 1995. Evaluation of the API 50CHB system for the identification and biochemical characterization of Bacillus larvae. Apidologie 26, 11–16.
Cheshire, F.R., Cheyne, W.W., 1885. The pathogenic history and history under cultivation of a new bacillus (B. alvei) the cause of a disease of bee hives hitherto known as foul brood. J. Roy. Mic. Soc. vol. 581.
Dancer, B.N., Chantawannakul, P., 1997. The proteases of American foulbrood scales. J. Invertebr. Pathol. 70, 79–87.
Davidson, E.W., 1970. Ultrastructure of perithrophic membrane development in larvae of the worker honey bee (Apis mellifera). J. Invertebr. Pathol. 15, 451–454.
Davidson, E.W., 1973. Ultrastructure of American foulbrood disease pathogenesis in larvae of the worker honey bee, Apis mellifera. J. Invertebr. Pathol. 21, 53–61.
De Graaf, D.C., De Vos, P., Heyndrickx, M., Van Trappen, S., Peiren, N., Jacobs, F.J., 2006. Identification of Paenibacillus larvae to the subspecies level: an obstacle for AFB diagnosis. J. Invertebr. Pathol. 91, 115–123.
Diatchenko, L., Lau, Y., Campbell, A., Chenchik, A., Moqadam, F., Hunag, B., Lukyanov, S., Lukyanov, K., Gurskaya, N., Sverdlov, E., Siebert, P., 1996. Suppression subtractive hybridization: a method for generating differentially regulated or tissue-specific cDNAprobes and libraries. Proc. Natl. Acad. Sci. USA 93, 6025–6030.
Djordjevic, S., Ho-Shon, M., Hornitzky, M., 1994. DNA restriction endonuclease profiles and typing of geographically diverse isolates of Bacillus larvae. J. Apic. Res. 33, 95–103.
Dobbelaere, W., de Graaf, D.C., Peeters, J.E., Jacobs, F.J., 2001. Comparison of two commercial kits for biochemical characterization of Paenibacillus larvae larvae in the diagnosis of AFB. J. Apic. Res. 40, 37–40.
Drobnikova, V., Richter, V., Häusler, J., Pytelova, I., 1994. Characterization of Bacillus larvae and related bacilli by chromatography of cell fatty acids. J. Apic. Res. 33, 69–74.
Dzierzon, J., 1882. Rational Bee-Keeping. Houlston and Sons, London.
Ebert, D., 1998. Experimental evolution of parasites. Science 282, 1432–1435.
Ebert, D., Herre, E.A., 1996. The evolution of parasitic diseases. Parasitol. Today 12, 96–100.
Ebert, T.A., Kevan, P.G., Bishop, B.L., Kevan, S.D., Downer, R.A., 2007. Oral toxicity of essential oils and organic acids fed to honey bees (Apis mellifera). J. Apic. Res. 46, 220–224.
Eguaras, M.J., Fuselli, S., Gende, L., Fritz, R., Ruffinengo, S.R., Clemente, G., Gonzalez, A., Bailac, P.N., Ponzi, M.I., 2005. An in vitro evaluation of Tagetes minuta essential oil for the control of the honeybee pathogens Paenibacillus larvae and Ascosphaera apis, and the parasitic mite Varroa destructor. J. Ess. Oil Res. 17, 336–340.
Evans, J.D., 2003. Diverse origins of tetracycline resistance in the honey bee bacterial pathogen Paenibacillus larvae. J. Invertebr. Pathol. 83, 46–50.
Evans, J.D., 2004. Transcriptional immune response by honey bee larvae during invasion by the bacterial pathogen, Paenibacillus larvae. J. Invertebr. Pathol. 85, 105–111.
Evans, J.D., Armstrong, T.N., 2005. Inhibition of the American foulbrood bacterium,
Paenibacillus larvae larvae, by bacteria isolated from honey bees. J. Apic. Res. 44, 168–171.
Evans, J.D., Armstrong, T.N., 2006. Antagonistic interactions between honey bee bacterial symbionts and implications for disease. BMC Ecol. 6, 4.
Evans, J.D., Lopez, D.L., 2004. Bacterial probiotics induce an immune response in the honey bee (Hymenoptera: Apidae). J. Econ. Entomol. 97, 752–756.
Evans, J.D., Spivak, M., 2010. Socialized medicine individual and communal disease barriers in honey bees. J. Invertebr. Pathol. 103, S62–S72.
Ewald, P.W., 1983. Host-parasite relations, vectors, and the evolution of disease severity. Ann. Rev. Ecol. Syst. 14, 465–485.
Forsgren, E., Stevanovic, J., Fries, I., 2008. Variability in germination and in temperature and storage resistance among Paenibacillus larvae genotypes. Vet. Microbiol. 129, 342–349.
Fries, I., Camazine, S., 2001. Implications of horizontal and vertical pathogen transmission for honeybee epidemiology. Apidologie 32, 199–214.
Fries, I., Lindström, A., Korpela, S., 2006. Vertical transmission of American foulbrood (Paenibacillus larvae) in honey bees (Apis mellifera). Vet. Microbiol. 114, 269–274.
Fünfhaus, A., Ashiralieva, A., Borriss, R., Genersch, E., 2009. Use of suppression subtractive hybridization to identify genetic differences between differentially virulent genotypes of Paenibacillus larvae, the etiological agent of American foulbrood of honeybees. Environ. Microbiol. Rep. 1, 240–250.
Fünfhaus, A., Ashiralieva, A., Genersch, E., 2008. Molecular differences between Paenibacillus larvae ERIC III/IV and ERIC I. Apidologie 39, 601.
Fünfhaus, A., Genersch, E., 2008. Molecular analysis and comparison of different genotypes of Paenibacillus larvae, the causative agent of American foulbrood of honeybees. Berl. Münch. Tierдrztl. Wschr. 121, 400.
Fuselli, S.R., de la Rosa, S.B.G., Eguaras, M.J., Fritz, R., 2008a. Chemical composition and antimicrobial activity of Citrus essences on honeybee bacterial pathogen Paenibacillus larvae, the causal agent of American foulbrood. World J. Microbiol. Biotechnol. 24, 2067–2072.
Fuselli, S.R., de la Rosa, S.B.G., Eguaras, M.J., Fritz, R., 2008b. Susceptibility of the honeybee bacterial pathogen Paenibacillus larvae to essential oils distilled from exotic and indigenous Argentinean plants. J. Ess. Oil Res. 20, 464–470.
Fuselli, S.R., de la Rosa, S.B.G., Gende, L.B., Eguaras, M.J., Fritz, R., 2006. Antimicrobial activity of some Argentinian wild plant essential oils against Paenibacillus larvae larvae, causal agent of American foulbrood (AFB). J. Apic. Res. 45, 2–7.
Fuselli, S.R., Garcia de la Rosa, S.B., Eguaras, M.J., Fritz, R., Ndagijimana, M., Vannini, L., Guerzoni, M.E., 2007. Efficacy of indigenous plant essential oil Andean thyme (Acantholippia seriphioides A. Gray) to control American foulbrood (AFB) in honey bee (Apis mellifera L.) hives. J. Ess. Oil Res. 19, 514–519.
Fuselli, S.R., Maggi, M.D., de la Rosa, S.B.G., Principal, J., Eguaras, M.J., Fritz, R., 2009. In vitro antibacterial and antiparasitic effect of citrus fruit essential oils on the honey bee pathogen Paenibacillus larvae and the parasitic mite Varroa destructor. J. Apic. Res. 48, 77–78.
Gallardo, G.L., Pena, N.I., Chacana, P., Terzolo, H.R., Cabrera, G.M., 2004. L-tenuazonic acid, a new inhibitor of Paenibacillus larvae. World J. Microbiol. Biotechnol. 20, 609–612.
Gende, L.B., Floris, I., Fritz, R., Eguaras, M.J., 2008. Antimicrobial activity of cinnamon (Cinnamomum zeylanicum) essential oil and its main components against Paenibacillus larvae from Argentine. Bull. Insectol. 61, 1–4.
Gende, L.B., Maggi, M.D., Fritz, R., Eguaras, M.J., Bailac, P.N., Ponzi, M.I., 2009. Antimicrobial activity of Pimpinella anisum and Foeniculum vulgare essential oils against Paenibacillus larvae. J. Ess. Oil Res. 21, 91–93.
Genersch, E., 2008. Paenibacillus larvae and American foulbrood–long since known and still surprising. J. Verbr. Lebensm. 3, 429–434.
Genersch, E., Ashiralieva, A., Fries, I., 2005. Strain- and genotype-specific differences in virulence of Paenibacillus larvae subsp. Larvae, the causative agent of American foulbrood disease in honey bees. Appl. Environ. Microbiol. 71, 7551–7555.
Genersch, E., Forsgren, E., Pentikдinen, J., Ashiralieva, A., Rauch, S., Kilwinski, J., Fries, I., 2006. Reclassification of Paenibacillus larvae subsp. Pulvifaciens and Paenibacillus larvae subsp. larvae as Paenibacillus larvae without subspecies differentiation. Int. J. Syst. Evol. Microbiol. 56, 501–511.
Genersch, E., Otten, C., 2003. The use of repetitive element PCR fingerprinting (rep-PCR) for genetic subtyping of German field isolates of Paenibacillus larvae subsp. Larvae. Apidologie 34, 195–206.
Gilliam, M., Dunham, D.R., 1978. Recent isolation of Bacillus pulvifaciens from powdery scales of honey bee, Apis mellifera. Larvae. J. Invertebr. Pathol. 32, 222–223.
Gregorc, A., Bowen, I.D., 1998. Histopathological and histochemical changes in honeybee larvae (Apis mellifera L.) after infection with Bacillus larvae, the causative agent of American foulbrood disease. Cell Biol. Int. 22, 137–144.
Hacker, J., Blum-Oehler, G., Muhldorfer, I., Tschape, H., 1997. Pathogenicity islands of virulent bacteria: structure, function and impact on microbial evolution. Mol. Microbiol. 23, 1089–1097.
Hansen, H., Brodsgaard, C.J., 1999. American foulbrood: a review of its biology, diagnosis and control. Bee World 80, 5–23.
Hasemann, L., 1961. How long can spores of American foulbrood live? Am. Bee J. 101, 298–299.
Heyndrickx, M., Vandemeulebroecke, K., Hoste, B., Janssen, P., Kersters, K., de Vos, P., Logan, N.A., Ali, N., Berkeley, R.C.W., 1996. Reclassification of Paenibacillus (formerly Bacillus) pulvifaciens (Nakamura 1984) Ash et al. 1994, a later synonym of Paenibacillus (formerly Bacillus) larvae (White, 1906) Ash et al. 1994, as a subspecies of P. larvae, with emended descriptions of P. larvae as P. larvae subsp. larvae and P. larvae subsp. pulvifaciens. Int. J. Syst. Bacteriol. 46, 270-279.
Higes, M., Suarez, M., Llorente, J., 1997. Comparative field trials of varroa mite control with different components of essential oils (thymol, menthol, and camphor). Res. Rev. Parasitol. 57, 21–24.
Higgins, C.F., Ames, G.F., Barnes, W.M., Clement, J.M., Hofnung, M., 1982. A novel intercistronic regulatory element of prokaryotic operons. Nature 298, 760–762.
Hitchcock, J.D., Stoner, A., Wilson, W.T., Menapace, D.M., 1979. Pathogenicity of Bacillus pulvifaciens to honeybee larvae of various ages (Hymenoptera: Apidae). J. Kansas Entomol. Soc. 52, 238–246.
Holst, E.C., 1946. A simple field test for American foulbrood. Am. Bee J. 86, 34.
Holst, E.C., Sturtevant, A.P., 1940. Relation of proteolytic enzymes to phase of life cycle of Bacillus larvae and two new culture media for this organism. Bacteriol 40, 723–731.
Hrabak, J., Martinek, K., 2007. Screening of secreted proteases of Paenibacillus larvae by using substrate-SDS–polyacrylamide gel electrophoresis. J. Apic. Res. 46, 160–164.
Hulton, C.S.J., Higgins, C.F., Sharp, P.M., 1991. ERIC sequences – a novel family of repetitive elements in the genomes of Escherichia coli, Salmonella typhimurium and other enterobacteria. Mol. Microbiol. 5, 825–834.
Julian, G.S., Bulla, L.A.J., 1971. Physiology of sporeforming bacteria associated with insects. J. Bacteriol. 108, 828–834.
Katznelson, H., 1950. Bacillus pulvifaciens (n. Sp.), an organism associated with powdery scale of honeybee larvae. J. Bacteriol. 59, 153–155.
Katznelson, H., Jamieson, C.A., 1951. Antibiotics and other chemotherapeutic agents in the control of bee diseases. Sci. Agr. 32, 219–225.
Kilwinski, J., Peters, M., Ashiralieva, A., Genersch, E., 2004. Proposal to reclassify Paenibacillus larvae subsp. pulvifaciens DSM 3615 (ATCC 49843) as Paenibacillus larvae subsp. Larvae. Results of a comparative biochemical and genetic study. Vet. Microbiol. 104, 31–42.
Kochansky, A., Pettis, J., 2005. Screening additional antibiotics for efficacy against American foulbrood. J. Apic. Res. 44, 24–28.
Kochansky, J., Knox, D.A., Feldlaufer, M., Pettis, J.S., 2001. Screening alternative antibiotics against oxytetracycline-susceptible and -resistant Paenibacillus larvae. Apidologie 32, 215–222.
Kühn, I., Burman, L.G., Haeggman, S., Tullus, K., Murray, B.E., 1995. Biochemical fingerprinting compared with ribotyping and pulsed-field gel-electrophoresis of DNA for epidemiologic typing of enterococci. J. Clin. Microbiol. 33, 2812–2817.
Lindström, A., Korpela, S., Fries, I., 2008a. The distribution of Paenibacillus larvae spores in adult bees and honey and larval mortality, following the addition of American foulbrood diseased brood or spore-contaminated honey in honey bee (Apis mellifera) colonies. J. Invertebr. Pathol. 99, 82–86.
Lindström, A., Korpela, S., Fries, I., 2008b. Horizontal transmission of Paenibacillus larvae spores between honey bee (Apis mellifera) colonies through robbing. Apidologie 39, 1–8.
Lloyd, J.M., 1986. Simplified laboratory diagnosis of American foulbrood disease. J. Apic. Res. 25, 55–57.
Lodesani, M., Costa, M., 2005. Limits of chemotherapy in beekeeping: development of resistance and the problem of residues. Bee World 86, 102–109.
Loncaric, I., Derakhshifar, I., Oberlerchner, J.T., Köglberger, H., Moosbeckhofer, R., 2009. Genetic diversity among isolates of Paenibacillus larvae from Austria. J. Invertebr. Pathol. 100, 44–46.
Martel, A.C., Zeggane, S., Drajnudel, P., Faucon, J.P., Aubert, M., 2006. Tetracycline residues in honey after hive treatment. Food Addit. Contam. 23, 265–273.
Martin, B., Humbert, O., Camara, M., Guenzi, E., Walker, J., Mitchell, T., et al., 1992. A highly conserved repeated DNA element located in the chromosome of Streptococcus pneumoniae. Nucleic Acids Res. 20, 3479–3483.
Miyagi, T., Peng, C.Y.S., Chuang, R.Y., Mussen, E.C., Spivak, M.S., Doi, R.H., 2000. Verification of oxytetracycline-resistant American foulbrood pathogen Paenibacillus larvae in the United States. J. Invertebr. Pathol. 75, 95–96.
Morse, R.A., Calderon, N.W., 2000. The value of honey bee pollination in the United States. Bee Cult. 128, 1–15.
Murray, K.D., Aronstein, K.A., 2006. Oxytetracycline-resistance in the honey bee pathogen Paenibacillus larvae is encoded on novel plasmid pMA67. J. Apic. Res. 45, 207–214.
Murray, K.D., Aronstein, K.A., 2008. Transformation of the gram-positive honey bee pathogen, Paenibacillus larvae, by electroporation. J. Microbiol. Meth. 75, 325–328.
Murray, K.D., Aronstein, K.A., de Leon, J.H., 2007. Analysis of pMA67, a predicted rolling-circle replicating, mobilizable, tetracycline-resistance plasmid from the honey bee pathogen, Paenibacillus larvae. Plasmid 58, 89–100.
Mussen, E.C., 2000. Antibiotic-resistant American foulbrood. Am. Bee J. 140, 300–301.
Neuendorf, S., Hedtke, K., Tangen, G., Genersch, E., 2004. Biochemical characterization of different genotypes of Paenibacillus larvae subsp. Larvae, a honey bee bacterial pathogen. Microbiology 150, 2381–2390.
Nordström, S., Fries, I., 1995. A comparison of media and cultural conditions for identification of Bacillus larvae in honey. J. Apic. Res. 34, 97–103.
Olive, D.M., Bean, P., 1999. Principles and application methods for DNA-based typing of microbial organisms. J. Clin. Microbiol. 37, 1661–1669.
Olofsson, T.C., Vasquez, A., 2008. Detection and identification of a novel lactic acid bacterial flora within the honey stomach of the honeybee Apis mellifera. Curr. Microbiol. 57, 356–363.
Peng, C.Y.S., Mussen, E.C., Fong, A., Cheng, P., Wong, G., Montague, M.A., 1996. Laboratory and field studies on the effect of the antibiotic tylosin on honey bee Apis mellifera L. (Hymenoptera: Apidae) development and prevention of American foulbrood disease. J. Invertebr. Pathol. 67, 65–71.
Peng, C.Y.S., Mussen, E.C., Fong, A., Montague, M.A., Tyler, T., 1992. Effects of chlortetracycline of honey bee worker larvae reared in vitro. J. Invertebr. Pathol. 60, 127–133.
Pentikдinen, J., Kalliainen, E., Pelkonen, S., 2009. Molecular epidemiology of Paenibacillus larvae infection in Finland. Apidologie 40, 73–81.
Pernal, S.F., Albright, R.L., Melathopoulos, A.P., 2008. Evaluation of the shaking technique for the economic management of American foulbrood disease of honey bees (Hymenoptera: Apidae). J. Econ. Entomol. 101, 1095–1104.
Peters, M., Kilwinski, J., Beringhoff, A., Reckling, D., Genersch, E., 2006. American foulbrood of the honey bee: occurrence and distribution of different genotypes of Paenibacillus larvae in the administrative district of Arnsberg (North Rhine-Westphalia). J. Vet. Med. B. 53, 100–104.
Piccini, C., Zunino, P., 2001. American foulbrood in Uruguay: isolation of Paenibacillus larvae larvae from larvae with clinical symptoms and adult honeybees and susceptibility to oxytretracycline. J. Invertebr. Pathol. 78, 176–177.
Plagemann, O., 1985. Eine einfache Kulturmethode zur bakteriologischen Identifizierung von Bacillus larvae mit Columbia-Blut-Schrägagar. Berl. Münch. Tierдrztl. Wschr. 98, 61–62.
Qin, X., Evans, J.D., Aronstein, K.A., Murray, K.D., Weinstock, G.M., 2006. Genome sequence of the honey bee pathogens Paenibacillus larvae and Ascosphaera apis. Insect Mol. Biol. 15, 715–718.
Rauch, S., Ashiralieva, A., Hedtke, K., Genersch, E., 2009. Negative correlation between individual-insect-level virulence and colony-level virulence of
Paenibacillus larvae, the etiological agent of American foulbrood of honeybees. Appl. Environ. Microbiol. 75, 3344–3347.
Reva, O., Tümmler, B., 2008. Think big-giant genes in bacteria. Environ. Microbiol. 10, 768–777.
Rothenbuhler, W.C., 1964a. Behaviour genetics of nest cleaning in honey bees. I. Responses of four inbred lines to disease-killed brood. Animal Behav. 12, 578–583.
Rothenbuhler, W.C., 1964b. Behaviour genetics of nest cleaning in honey bees. IV. Responses of F1 and backcross generations to disease-killed brood. Am. Zool. 4, 111–123.
Schirach, G.A., 1769. Histoire des Abeilles. p. 56 (Chapter 3). Schmidt, H., Hensel, M., 2004. Pathogenicity islands in bacterial pathogenesis. Clin. Microbiol. Rev. 17, 14–56.
Schwartz, D.C., Cantor, C.R., 1984. Separation of yeast chromosome-sized DNAs by pulsed field gradient gel-electrophoresis. Cell 37, 67–75.
Shapiro-Ilan, D.I., Fuxa, J.R., Lacey, L.A., Onstad, D.W., Kaya, H.K., 2005. Definitions of pathogenicity and virulence in invertebrate pathology. J. Invertebr. Pathol. 88, 1–7.
Sharples, G.J., Lloyd, R.G., 1990. A novel repeated DNA-sequence located in the intergenic regions of bacterial chromosomes. Nucleic Acids Res. 18, 6503–6508.
Spivak, M.S., Reuter, G.S., 1998. Performance of hygienic honey bee colonies in a commercial apiary. Apidologie 29, 291–302.
Spivak, M.S., Reuter, G.S., 2001. Resistance to American foulbrood disease by honey bee colonies Apis mellifera bred for hygienic behavior. Apidologie 32, 555–565.
Stern, M.J., Ames, G.F.L., Smith, N.H., Robinson, E.C., Higgins, C.F., 1984. Repetitive extragenic palindromic sequences – a major component of the bacterial genome. Cell 37, 1015–1026.
Sturtevant, A.P., 1932. Relation of commercial honey to the spread of American foulbrood. J. Agricul. Res. 45, 257–285.
Tenover, F.C., Arbeit, R.D., Goering, R.V., Mickelsen, P.A., Murray, B.E., Persing, D.H., Swaminathan, B., 1995. Interpreting chromosomal DNA restriction patterns produced by pulsed-field gel-electrophoresis – criteria for bacterial strain typing. J. Clin. Microbiol. 33, 2233–2239.
Versalovic, J., Kapur, V., Koeuth, T., Mazurek, G.H., Whittam, T.S., Musser, J.M., Lupski, J.R., 1995. DNA-fingerprinting of pathogenic bacteria by fluorophoreenhanced repetitive sequence-based polymerase chain-reaction. Arch. Pathol. Lab. Med. 119, 23–29.
Versalovic, J., Koeuth, T., Lupski, J.R., 1991. Distribution of repetitive DNA-sequences in eubacteria and application to fingerprinting of bacterial genomes. Nucleic Acids Res. 19, 6823–6831.
Versalovic, J., Schneider, M., de Bruijn, F.J., Lupski, J.R., 1994. Genomic fingerprinting of bacteria using repetitive sequence-based polymerase chain reaction. Methods Mol. Cell. Biol. 5, 25–40.
von der Ohe, W., 2003. Control of American Foulbrood by using alternatively eradication method and artificial swarms. Apiacta 38, 137–139.
Vos, P., Hogers, R., Bleeker, M., Reijans, M., Vandelee, T., Hornes, M., et al., 1995. AFLP – a new technique for DNA-fingerprinting. Nucleic Acids Res. 23, 4407–4414.
Wedenig, M., Riessberger-Galle, U., Crailsheim, K., 2003. A substance in honey bee larvae inhibits the growth of Paenibacillus larvae larvae. Apidologie 34, 43–51.
White, G.F., 1906. The bacteria of the apiary with special reference to bee disease. USDA, Bureau of Entomology, Technical Series. 14, 1–50.
Williams, J.G.K., Kubelik, A.R., Livak, K.J., Rafalski, J.A., Tingey, S.V., 1990. DNA polymorphisms amplified by arbitrary primers are useful as genetic markers. Nucleic Acids Res. 18, 6531–6535.
Williams, J.R., Peng, C.Y.S., Chuang, R.Y., Doi, R.H., Mussen, E.C., 1998. The inhibitory effect of azadirachtin on Bacillus subtilis, Escherichia coli, and Paenibacillus larvae, the causative agent of American foulbrood in the honeybee, Apis mellifera L. J. Invertebr. Pathol. 72, 252–257.
Wilson-Rich, N., Spivak, M.S., Fefferman, N.H., Starks, P.T., 2009. Genetic, individual, and group facilitation of disease resistance in insect societies. Annu. Rev. Entomol. 54, 405–423.
Wilson, W.T., 1971. Resistance to American foulbrood in honey bees XI. Fate of Bacillus larvae spores ingested by adults. J. Invertebr. Pathol. 17, 247–255.
Woodrow, A.W., 1942. Susceptibility of honeybee larvae to individual inoculations with spores of Bacillus larvae. J. Econ. Entomol. 35, 892–895.
Woodrow, A.W., Holst, E.C., 1942. The mechanism of colony resistance to American foulbrood. J. Econ. Entomol. 35, 327–330.
Yue, D., Nordhoff, M., Wieler, L.H., Genersch, E., 2008. Fluorescence in situhybridization (FISH) analysis of the interactions between honeybee larvae and Paenibacillus larvae, the causative agent of American foulbrood of honeybees (Apis mellifera). Environ. Microbiol. 10, 1612–1620.
