Что известно о трихомонадной инфекции кошек?
Tritrichomonas foetus
Tritrichomonas foetus — это одноклеточный эукариотический организм, локализуется в толстом кишечнике кошачьих и является возбудителем трихомоноза, заболевания с хронической и рецидивирующей диареей с примесью слизи и свежей крови в кале. Животные, зараженные T. foetus, зачастую не реагируют на обычное лечение. Диагностика трихомонадной инфекции проводится либо микроскопическим исследованием, либо путем выделения ДНК в кале с последующей амплификацией.
T. foetus часто ошибочно идентифицируют как другое жгутиковое простейшее: Giardia duodenalis или Pentatrichomonas hominis.
Без надлежащего лечения диарея может проходить самопроизвольно через месяцы или годы, но кошки при этом могут оставаться носителям.
Вступление
Tritrichomonas foetus — это трихомонада, которая впервые была описана как бычий венерический патоген, вызывающий бесплодие, аборты и эндометриты (FELLEISEN, 1999; STOCKDALE et al., 2006). Более десяти лет назад T. foetus был также идентифицирован в кале домашних кошек с хронической диареей (GOOKIN et al., 1999; LEVY et al., 2003). Трихомонады обнаружены как у кошек с диареей и так без нее (DA CUNHA & MUNIZ, 1922; JORDAN, 1956), но их считали комменсальными и условно-патогенными организмами (DIMSKI, 1989; BARR, 1998).
Возможно, долгое время T. foetus при микроскопии путали с Pentatrichomonas spp. [Eukaryota; Parabasalia; Trichomonadida; Trichomonadidae] или Giardia spp. [Eukaryota; Fornicata; Diplomonadida; Hexamitidae; Giardiinae] (GOOKIN et al., 1999); однако, благодаря генетической идентификации в 2003 году T. foetus был признан возбудителем трихомоноза кошек (LEVY et al., 2003).
Поскольку трихомоноз кошек был идентифицирован как заболевание желудочно-кишечного тракта, исследователи обратили свой интерес к пониманию его этиологии, эпидемиологии и патогенеза, а также к диагностике и лечению (GOOKIN et al., 1999, 2006, 2010; GREY et al., 2010).
Таксономия
Трихомонады вида Tritrichomonas foetus представляют собой анаэробные простейшие организмы отряда Trichomonadida семейства Trichomonadidae (BRUGEROLLE & LEE, 2000). Новая систематика классифицирует трихомонады как [cellular organisms; Eukaryota; Parabasalia; Tritrichomonadida; Tritrichomonadidae; Tritrichomonas].
Историческая справка
Трихомоноз был впервые описан у кошки в Бразилии Da Cunha и Muniz в 1922 году, которые назвали возбудителя Trichomonas felis. Спустя годы Brumpt (1925) выявил трихомонад с тремя-пятью передними жгутиками у собак и кошек во Франции, приняв название Trichomonas felis для обоих видов животных. Год спустя Tanabe выявил паразита, Pentatrichomonas spp. у кошки, дав ему название Pentatrichomonas felis (TANABE, 1926).
Kessel (1928) наблюдал естественный и экспериментальный трихомоноз у девяти котят. Животные страдали диареей, которая прогрессировала до дизентерии. Котята умерли в течение 10 дней после заражения.
В 1956 году молодой кошке с хронической диареей был поставлен диагноз трихомоноз, описанный как инфекция, вызванная Trichomonas spp. (JORDAN, 1956).
В период с 1956 по 1996 год исследований практически не проводили, т.к. трихомонад кошек считали непатогенным комменсальными видами, которых выявляли только при предшествующих энтеритах (DIMSKI, 1989; BARR, 1998; GOOKIN и др., 1999). В 1996 году, основываясь на микроскопическом исследовании мазков из фекалий, Romatowski (1996, 2000) установил, что Pentatrichomonas hominis вызывают мукоидную диарею у котят и взрослых кошек.
В 2001 году после молекулярного анализа гена 18S р-РНК изолятов трихомонад они были идентифицированы как Tritrichomonas foetus со сходством 99,9% (LEVY et al., 2003).
Tritrichomonas foetus также был обнаружен в репродуктивных органах кошки с пиометрой в Норвегии, хотя причиной инфекции в матке были бактерии Streptococcus spp., которые присутствовали в секреции половых органов (DAHLGREN et al., 2007).
Gray et al. (2010) исследовали репродуктивные органы 15 кошек, у которых ранее была диагностирована кишечная инфекция, вызванная T. foetus. Они использовали световую микроскопию, иммуногистохимический анализ и ПЦР анализ и не обнаружили никаких признаков паразита.
Молекулярная генетика
В нескольких исследованиях описаны возбудители крупного рогатого скота и их возможность быть источником инфекции для кошек. Однако, эпидемиологическое исследование кошек не выявило связи между инфекцией T. foetus и близостью к крупному рогатому скоту (GOOKIN et al., 2004). Исследования, связанные с перекрестным заражением, проведенные Stockdale et al. (2007, 2008), показали фенотипические различия между инфекционностью и патогенностью изолятов, выявленных у кошек и крупного рогатого скота (КРС). Молекулярные исследования показали так же и генетические различия между изолятами. Slapeta et al. (2010) предложили видоспецифические различия между генотипами T. foetus крупного рогатого скота и кошек. Другие исследователи также наблюдали немногочисленные, но постоянные генетические различия между изолятами. Sun et al. (2012) выявили отличия в цистеиновой протеазе 8 изолятов от КРС и кошек, объясняя это как возможную адаптацию к хозяину.
Новое название — Tritrichomonas blagburni было предложено для паразита кошек, чтобы отделить его от бычьего паразита (WALDEN et al., 2013). По мнению авторов, специфичность хозяина, а также морфологическая и генетическая информация должны учитываться при любой таксономической оценке. С научной точки зрения это по-прежнему считается спорным, так как данные, полученные из сравнительного анализа двух транскриптомов, не смогли подтвердить, что они являются двумя различными видами (MORIN-ADELINE et al., 2014).
Кроме того, исследования показали, что Tritrichomonas suis — трихомонада домашней свиньи, морфологически неотличима от T. foetus. Секвенирование вариабельного фрагмента ДНК и сравнение последовательностей генов не выявили различий между изолятами T.suis и T. foetus КРС. Таким образом, исследователи пришли к выводу, что T. foetus и T. suis принадлежат к одному и тому же виду, предполагая, что наименования паразитов являются синонимичными (TACHEZY et al., 2002; LUN et al., 2005).
Морфология
Простейшие T. foetus имеют только трофозоитную стадию. Это маленькие жгутиковые размером от 10 до 25 мкм в длину и от 3 до 15 мкм в ширину (GOOKIN et al., 2006). У них грушевидное тело, одно ядро, три передних жгутика и один задний жгутик (WARTON̄A & HONIGBERG, 1979). Задний жгутик проходит вдоль тела паразита, образуя волнообразную мембрану (GOOKIN et al., 2006). Аксостиль — твердая органелла, проходит по длине тела паразита (LEVINE, 1985) и выступает на заднем конце (GOOKIN et al., 2006).
Жизненный цикл
Жизненный цикл трихомонады представляет собой простой бесполый цикл, в котором трофозоит делится продольным бинарным делением. Передача возбудителя происходит при проглатывании трофозоитов, т.е. алиментарным путем (GOOKIN et al., 2017).
Нет истинной стадии цисты, но некоторые авторы описывают, что в неблагоприятных условиях окружающей среды (дефицит питательных веществ, действие лекарств или резкие изменения температуры) может происходить образование псевдоцист. В этом случае жгутики исчезают, но клетка не образует истиной цисты (PEREIRA-NEVES et al., 2003; PEREIRA-NEVES & BENCHIMOL, 2009; ROSA et al., 2015).
Факторы заражения
Передача T. foetus между кошками происходит фекально-оральным путем (GOOKIN et al., 1999, 2001). Прямого контакта со свежими испражнениями может быть достаточно для передачи паразита, так как T. foetus не попадает в виде цист в окружающую среду.
Однако Hale et al. (2009) обнаружили, что трофозоиты T. foetus более устойчивы к условиям окружающей среды, чем считалось ранее, выживая во влажных фекалиях в течение семи дней при комнатной температуре (23-20℃).
Способность паразита выживать вне хозяина может быть важным фактором в эпидемиологии заболевания, особенно в местах большого скопления кошек. Эта живучесть также позволяет предположить, что вылизывание животными друг друга и загрязнение окружающей среды фекалиями являются важными факторами в эпидемиологии заболевания (HALE et al., 2009; VAN DER SAAG et al., 2010).
Хотя теоретическая передача T. foetus между крупным рогатым скотом и кошками возможна, прямая передача не является основным источником инфекции (STOCKDALE et al., 2008). Gookin et al. (2004) не обнаружили никакой связи между инфекцией кошек и их близостью к КРС.
Факторы риска
Tritrichomonas foetus преимущественно выявляют у молодых кошек. Большинство исследований показало, что средний возраст заражения — 12 месяцев или менее; болеют же трихомонозом животные в возрасте от 4 недель до 16 лет (GOOKIN et al., 1999, 2004; BURGENER et al., 2009; FREY et al., 2009).
Во многих исследованиях зараженным кошкам был 1 год или они были моложе (FOSTER et al., 2004; GOOKIN et al., 2004; YAEGER & GOOKIN, 2005; STOCKDALE et al., 2009; ARRANZ‑SOLÍS et al., 2016).
Holliday et al. (2009) обнаружили инфицированных кошек в группе, в которой преобладали животные старше 1 года. Вероятное объяснение этого расхождения заключается в том, что инфекция, возможно, впервые попала в популяцию, а отсутствие защиты со стороны иммунной системы способствовало проявлению клинических признаков (HOLLIDAY et al., 2009).
У кошек, особенно моложе 3-х лет, инфекция может протекать бессимптомно и они могут стать источником заражения для других кошек (XENOULIS et al., 2010).
Половой предрасположенности к заражению среди кошек, инфицированных T. foetus, не описано ни в одном исследовании (GOOKIN et al., 2004; GUNN-MOORE et al., 2007; BURGENER et al., 2009; STOCKDALE et al., 2009).
В большинстве исследований чистокровные кошки заражались чаще (GUNN-MOORE и др., 2007; BURGENER и др., 2009; FREY и др., 2009; STOCKDALE и др., 2009; BELL и др., 2010; KLEIN и др., 2010). И наоборот, два исследования показали, что инфекция также распространена у кошек смешанных пород (GOOKIN et al., 1999; HOLLIDAY et al., 2009). Поскольку инфекция T. foetus чаще встречается в питомниках и приютах (GOOKIN et al., 1999; FOSTER et al., 2004), неизвестно, выявляется ли она чаще у чистокровных кошек из-за генетической предрасположенности или из-за того, что данные кошки обычно живут в местах агломерации T. foetus (HOLLIDAY et al., 2009).
Роль лечения и скученного содержания, в отличие от генетической предрасположенности, может быть ответом на более высокую распространенность инфекции среди чистокровных кошек. Это объяснение подтверждается высокой распространенностью инфекции среди кошек смешанных пород в приютах с плохими санитарными условиями (HOLLIDAY et al., 2009).
Gookin et al. (2004) не обнаружили значительной связи между инфекцией T. foetus и кошачьими туалетами, но плотность популяции кошек связана с передачей возбудителя через туалет (GOOKIN et al., 2007).
Неизвестно, влияет ли иммунный статус животного на патогенез T. foetus. С другой стороны, высокая распространенность инфекции среди молодых животных может указывать на склонность к заражению животных с незрелой иммунной системой (GOOKIN et al., 1999). Однако, в экспериментальном исследовании не было подтверждено ухудшения течения диареи при применении иммунодепрессивной дозы преднизолона (GOOKIN et al., 2001). Кроме того, по-видимому, нет никакой связи между T. foetus и иммуносупрессивными заболеваниями, такими как вирусная лейкемия кошек (FeLV) и вирусным иммунодефицитом (FIV) (GOOKIN et al., 1999; ROSADO et al., 2007).
Ко-инфекции другими энтеропатогенами можно часто наблюдать у кошек, зараженных T. foetus (GOOKIN et al., 2004). Некоторые авторы задаются вопросом, является ли T. foetus изолированной причиной диареи или сопутствующие инфекции приводят к тому, что кошки становятся более уязвимыми для паразита (STOCKDALE et al., 2009).
В некоторых исследованиях описано распространение ко-инфекции T. foetus с Giardia spp. (GOOKIN et al., 2004). Gookin et al. (2004) обнаружили ко-инфекцию T. foetus и Giardia spp. у 12% кошек, но эта связь не была значимой. Steiner et al. (2007) отметили, что большинство зараженных кошек в их исследовании также были положительными по Giardia spp. Bissett et al. (2008) сообщили, что 66% изученных кошек были ко-инфицированы.
Также часто сообщалось о ко-инфекции кокцидиями (STOCKDALE et al., 2009; GOOKIN et al., 2001, 2005; BISSETT et al., 2008). Gookin et al. (2001) экспериментально заразил восемь кошек (четыре из которых уже были заражены Cryptosporidium spp. [Eukaryota; Alveolata; Apicomplexa; Conoidasida; Coccidia; Eucoccidiorida; Eimeriorina; Cryptosporidiidae]) изолятом T. foetus. После заражения изолятом T. foetus у кошек с Cryptosporidium spp. понос появился раньше и был более тяжелым и у них было обнаружено большее количество трофозоитов, чем у кошек без кокцидий (без Cryptosporidium spp). С другой стороны, не было различий в количестве выделяемых ооцист.
Распространенность
Исследования трихомоноза кошек в нескольких странах показали, что T. foetus распространен среди домашних кошек во всем мире (STEINER et al., 2007). Глобальная распространенность T. foetus среди домашних кошек с диареей и без нее колеблется в пределах 0-81,8% в зависимости от количества проанализированных образцов, используемого метода диагностики, географического региона и образа жизни кошек.
Патогенез
Поскольку это недавно описанный паразит, патогенез T. foetus у кошек до сих пор полностью не изучен (TOLBERT & GOOKIN, 2016). Существуют лишь гипотезы о том, вызывает ли паразит клинические признаки самостоятельно или трихомоноз кошек может быть многофакторным заболеванием, связанным с кишечными ко-инфекциями и факторами, зависящими от хозяина (GOOKIN et al., 2004).
T. foetus локализуется в подвздошной, слепой и ободочной кишках кошек (GOOKIN et al., 2001; STOCKDALE et al., 2008).
Эксперименты продемонстрировали цитотоксическую и протеолитическую активность T. foetus в отношении клеток млекопитающих (BURGESS & MCDONALD, 1992). Инфекция характеризуется умеренной лимфоплазмоцитарной и нейтрофильной инфильтрацией подслизистой оболочки (YAEGER & GOOKIN, 2005). Описано истончение эпителия ободочной кишки, гипертрофия крипт, гиперплазия и повышенная митотическая активность, потеря бокаловидных клеток и микроабсцессы крипт. (SCHREY et al., 2009). Также иногда можно наблюдать эозинофелию (YAEGER & GOOKIN, 2005; SCHREY et al., 2009).
Некоторые факты наводят на мысль, что бактерии, присутствующие в ободочной кишке, являются важной частью патогенеза диареи у кошек, зараженных T. foetus. Например, диарея у этих животных обычно замедляется введением антибиотиков (GOOKIN et al., 1999, 2001). При этом не известно, уменьшают ли антибиотики бактериальный вклад в патогенез диареи или просто уменьшается количество T. foetus за счет уменьшения питательной базы (TOLBERT & GOOKIN, 2016).
Кошки с хроническим течением болезни могут демонстрировать длительные периоды клинической ремиссии; повторяющиеся эпизоды диареи могут быть вызваны диетическими изменениями или стрессовыми ситуациями, которые могут изменить микробиоту кишечника (FOSTER et al., 2004).
Клиническая картина
Клиническая картина варьируется от субклинического течения болезни до тяжелых случаев (FOSTER et al., 2004). При экспериментальном пероральном заражении клинические признаки появлялись через 2-7 дней (GOOKIN et al., 2001).
Клинические признаки включают хроническую или прерывистую диарею, желтовато-зеленые, зловонные фекалии и признаки колита: присутствие крови, слизи, недержание кала, тенезмы и/или метеоризм (GOOKIN et al., 2001; XENOULIS et al., 2013). Консистенция фекалий обычно варьируется от полуоформленной до жидкой (SCHREY et al., 2009; XENOULIS et al., 2010). При тяжелых случаях заболевания может развиться воспаление анальной области и выпадение прямой кишки (FOSTER et al., 2004; BURGENER et al., 2009).
Как и ожидалось, при заболевании, которое обычно поражает толстый кишечник, у большинства инфицированных кошек общее состояние организма хорошее, без системных нарушений (GOOKIN et al., 1999, 2001; TOLBERT & GOOKIN 2009), хотя у каждой пятой инфицированной кошки можно наблюдать анорексию, депрессию, потерю веса, рвоту и лихорадку (STOCKDALE et al., 2007).
Клинические признаки заболевания присутствуют в течение 5-24 месяцев, в среднем в течение 9 месяцев, после постановки диагноза (FOSTER et al., 2004). Степень выраженности клинических признаков варьируется от бессимптомных случаев до тяжелой диареи (FOSTER et al., 2004; GREY et al., 2010; XENOULIS et al., 2010).
Диагностика
Поскольку паразит имеет только фазу трофозоита, он не может быть идентифицирован в рутинными копропаразитологическими методами и не выдерживает охлаждения. Следовательно, диагностика инфекции T. foetus требует более специфического подхода (GOOKIN et al., 1999).
Диагноз может быть поставлен путем исследования мазка свежего кала (GOOKIN et al., 1999), высеиванием из фекалий на специфические питательные среды (GOOKIN et al., 2003) или при помощи ПЦР (GOOKIN et al., 2002); последний метод является наиболее широко используемым среди описанного в литературе. Кроме того, паразит может быть идентифицирован при помощи гистопатологического анализа биопсии кишечника (GOOKIN et al., 2001; YAEGER & GOOKIN, 2005).
| Подходящие образцы: |
| — свежий кал |
| — образцы, отобранные при помощи фекальной петли |
| — образцы, отобранные при помощи метода промывки толстой кишки, при котором приблизительно 10 мл стерильного физиологического раствора вводят через катетер в кишечник, а затем аспирируют (TOLBERT & GOOKIN, 2009; YAO & KOSTER, 2015) |
Образцы фекалий должны быть свежими, не содержать загрязняющего мусора и должны храниться без охлаждения до проведения анализа (TOLBERT & GOOKIN, 2009). Чтобы максимизировать чувствительность микроскопии и культивирования, анализ должен быть проведен в течение 6 часов после отбора материала (HALE et al., 2009).
Методы диагностики требуют наличия в кале паразитических трофозоитов. Колебания выхода трофозоитов характерны для венерического трихомоноза у крупного рогатого скота (SKIRROW et al., 1985). У кошек элиминация трофозоитов в кале, вероятно, тоже должна быть прерывистой (GOOKIN et al., 2001; STOCKDALE et al., 2008; HALE et al., 2009) и может быть снижена после терапии (GOOKIN et al., 1999; FOSTER и др., 2004; TOLBERT & GOOKIN, 2009).
Рис.1. Мазки фекалий 6-месячной кошки породы Мейн-кун с хронической диареей, окрашенные раствором Люголя (a-c) и окраской по Романовскому-Гимзе (d-f). (A), (d) — трофозоит Giardia duodenalis (Giardia lamblia); (b) и (e) — циста Giardia duodenalis (Giardia lamblia); (c) и (f) — трихомонады каплевидной формы (ув. х630) (Zanzani et al., 2016).
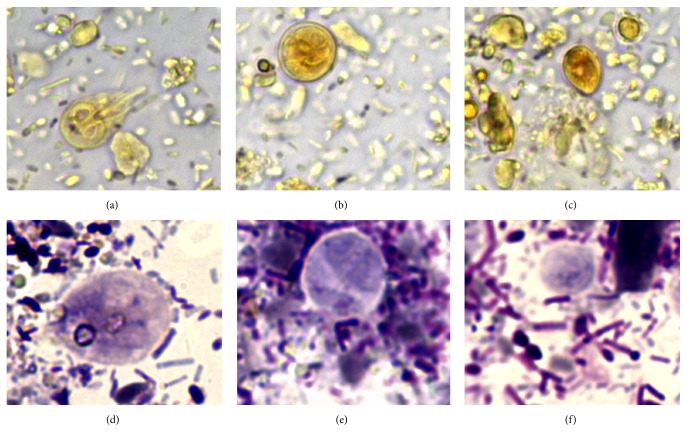
Рис.2. Трихомонады в мазках фекалий кошки, страдающей диареей. Наконечник стрелки на рис. (а) указывают на передние жгутики трофозоита, а наконечники стрелок на (b) указывает на волнистую мембрану (ув. х1000) (Zanzani et al., 2016).
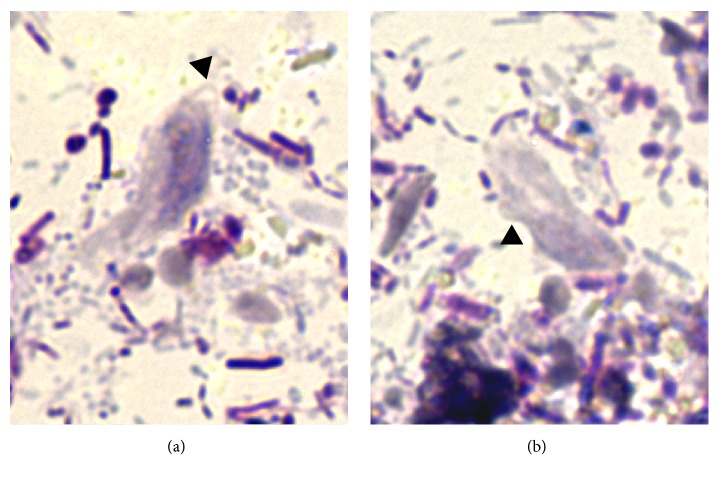
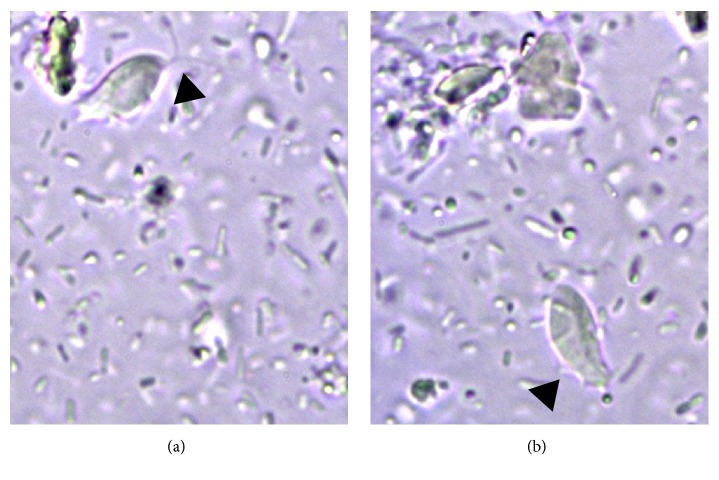
Рис.3. Трихомонада в разбавленном физиологическим раствором свежем мазке фекалий кошки, страдающей диареей. Стрелки на (a) и (b) указывают на передние жгутики и волнообразную мембрану соответственно (ув. х630) (Zanzani et al., 2016).
Посев из кала — это чувствительный и специфический метод диагностики инфекции T. foetus у кошек (GOOKIN et al., 2003). Недостатком данного метода является то, что он требует жизнеспособных трофозоитов. При низких температурах и сухости среды T. foetus может умереть. Исследования показали, что фекалии, которых хранили при комнатной температуре не более 6 часов, представляют собой подходящий материал для диагностического исследования методом посева (HALE et al., 2009). Добавление физиологического раствора к фекалиям рекомендуется, если образец будет транспортироваться или храниться какое-то время до культивирования. Кроме того, в пробе фекалий не должно быть песка, т.к. он может привести к высыханию пробы и гибели паразита (GOOKIN et al., 2003).
ПЦР анализ считается специфическим и более чувствительным методом обнаружения T. foetus, поскольку он не требует жизнеспособных трофозоитов (GOOKIN et al., 2002; VERMEULEN, 2009). Gookin et al. (2004) установили чувствительность ПЦР метода в 94,4% (GOOKIN et al., 2004).
Трофозоиты T. foetus также могут быть обнаружены гистопатологическими методами, но их сохранение в образцах биопсии затруднено из-за их недолговечности. Yaeger и Gookin (2005) наблюдали паразитов в фиксированных формалином тканях ободочной кишки. Иммуногистохимия, флуоресценция и хромогенная гибридизация in situ представляют собой методы, разработанные для локализации и идентификации паразита в образцах тканей, содержащихся в формалине, но коммерчески недоступны (GOOKIN et al., 2010).
Лечение
Поиск эффективного и безопасного лечения инфекции T. foetus у кошек продолжается. Паразит продемонстрировал низкую чувствительность к нескольким противомикробным препаратам, используемых для лечения простейших, локализованных в кишечнике, и лечения трихомонозов влагалища человека, включая такие препараты как метронидазол и тинидазол (GOOKIN et al., 1999; ROMATOWSKI, 2000; GOOKIN et al., 2001; KATHER et al., 2007).
Ронидазол в настоящее время является «препаратом выбора» для лечения T. foetus (GOOKIN et al., 2006). Препарат быстро всасывается в проксимальном отделе тонкого кишечника, метаболизируется и выводится печенью и почками (ROSADO et al., 2007; LEVINE et al., 2011). Текущая рекомендуемая доза составляет 30 мг/кг один раз в день в течение 14 дней (LEVINE et al., 2011). Высокие дозы ронидазола ассоциированы с симптомами нейротоксичности; ее признаки отмечаются через три дня после начала лечения и прекращаются в течение одной-четырех недель после отмены препарата (ROSADO et al., 2007). Нейротоксические эффекты зависят от дозы и могут быть связаны с длительным периодом полувыведения препарата. У кошек с нейротоксичностью можно наблюдать потерю аппетита, психические изменения, летаргию, атаксию, тремор морды, гиперестезию, слабость тазовых конечностей и иногда судороги (LEVINE et al. 2011). Данным кошкам может потребоваться интенсивная ветеринарная поддержка для устранения побочных эффектов (ROSADO et al., 2007).
После приема препарата консистенция фекалий инфицированных кошек обычно быстро улучшается в течение нескольких дней и полностью нормализуется после двухнедельного лечения (GOOKIN et al., 2006; BURGENER et al., 2009; HOLLIDAY et al., 2009; BELL et al., 2010). В некоторых случаях у инфицированных кошек диарея может не проходить в течение нескольких недель после начала лечения из-за выраженного колита (TOLBERT & GOOKIN, 2009). Симптомы заболевания могут вернуться после лечения, так как не всегда происходит полное изгнание паразита (BURGENER et al., 2009; GOOKIN et al., 2010). Инфекция обычно проходит после повторного лечения (GOOKIN et al., 2006).
Исследования показали, что лечение другими лекарственными средствами, такими как фенбендазол, паромомицин, тинидазол, метронидазол и фуразолидон, улучшало консистенцию кала в течение всего периода лечения, но, т.к. возбудитель не был ликвидирован, диарея возвращалась после прекращения лечения (KATHER et al., 2007).
Прогноз
Прогноз по T. foetus хороший. У 88% кошек с диареей консистенция кала самостоятельно нормализуется через 2 года после заражения (FOSTER et al., 2004).
Средняя продолжительность диареи составляет 135 дней (XENOULIS et al., 2010). Однако самопроизвольное устранение T. foetus встречается редко. Рецидивирующая диарея, связанная со стрессом или изменениями во флоре кишечника, является распространенным явлением (FOSTER et al., 2004). Кроме того, исследования показывают, что хроническая инфекция может предрасполагать кошек к воспалительным процессам в кишечнике (GOOKIN et al., 2001).
Профилактика
Котята и молодые животные, выращенные в условиях агломерации, более подвержены инфекции из-за стресса или иммунной незрелости. Таким образом, минимизация стресса и избежание скученности являются важными факторами для снижения вероятности развития трихомоноза. Как упоминалось ранее, паразит стабилен и жизнеспособен в окружающей среде в течение нескольких дней, что подчеркивает необходимость хорошей дезинфекции лежаков, транспортных сумок и туалетов (HALE et al., 2009).
Заключение
Кошачий трихомоноз является относительно новой проблемой ветеринарной медицины и вызывается паразитом T. foetus. Болезнь может протекать бессимптомно или в виде хронической диареи. Диагноз может быть сложным, так как требует более специфических исследований. К сожалению, микроскопия в большинстве ветеринарных клиник все еще не является рутиной. Знание этой новой болезни важно для постановки верного диагноза и правильного лечения.
References
Adl SM, Simpson AG, Farmer MA, Andersen RA, Anderson OR, Barta JR, et al. The new higher level classification of eukaryotes with emphasis on the taxonomy of protists. J Eukaryot Microbiol 2005; 52(5): 399-451. http://dx.doi.org/10.1111/j.1550-7408.2005.00053.x. PMid:16248873.
Arranz-Solís D, Pedraza-Díaz S, Miró G, Rojo-Montejo S, Hernández L, Ortega-Mora LM, et al. Tritrichomonas foetus infection in cats with diarrhea from densely housed origins. Vet Parasitol 2016; 221: 118-122. ttp://dx.doi.org/10.1016/j.vetpar.2016.03.019. PMid:27084482.
Barr SC. Enteric protozoal infections. In: Greene CE. Infectious diseases of the dog and cat. 2nd ed. Philadelphia: WB Saunders; 1998. p. 482-91.
Bell ET, Gowan RA, Lingard AE, McCoy RJ, Slapeta J, Malik R. Naturally occurring Tritrichomonas foetus infections in Australian cats: 38 cases. J Feline Med Surg 2010; 12(12): 889-898. http://dx.doi.org/10.1016/j. jfms.2010.06.003. PMid:20817588.
Bissett SA, Gowan RA, O’Brien CR, Stone MR, Gookin JL. Feline diarrhoea associated with Tritrichomonas foetus and Giardia co-infection in an Australian cattery. Aust Vet J 2008; 86(11): 440-443. http://dx.doi. org/10.1111/j.1751-0813.2008.00356.x. PMid:18959533.
Bissett SA, Stone ML, Malik R, Norris JM, O’Brien C, Mansfield CS, et al. Observed occurrence of Tritrichomonas foetus and other enteric parasites in Australian cattery and shelter cats. J Feline Med Surg 2009; 11(10): 803-807. http://dx.doi.org/10.1016/j.jfms.2009.02.001. PMid:19285895.
BonDurant RH, Campero CM, Anderson ML, Van Hoosear KA. Detection of Tritrichomonas foetus by polymerase chain reaction in cultured isolates, cervicovaginal mucus, and formalin-fixed tissues from infected heifers and fetuses. J Vet Diagn Invest 2003; 15(6): 579-584.http://dx.doi.org/10.1177/104063870301500613. PMid:14667024.
Brugerolle G, Lee J. Phylum Parabasalia. In: Lee J, Leedale G, Bradbury P (eds.). The Illustrated Guide to the Protozoa. 2nd ed. Society of Protozoologists, Lawrence; 2000. p. 1196-1210.
Brumpt E. Recherches morphologiques et expérimentales sur le Trichomonas felis Da Cunha et Muniz, 1922, parasite du chat et du chien. Ann Parasitol Hum Comp 1925; 3(3): 239-251. http://dx.doi.org/10.1051/ parasite/1925033239.
Burgener I, Frey CF, Kook P, Gottstein B. Tritrichomonas foetus: a new intestinal parasite in Swiss cats. Schweiz Arch Tierheilkd 2009; 151(8): 383- 389. http://dx.doi.org/10.1024/0036-7281.151.8.383. PMid:19653162.
Burgess DE, McDonald CM. Analysis of adhesion and cytotoxicity of Tritrichomonas foetus to mammalian cells by use of monoclonal antibodies. Infect Immun 1992; 60(10): 4253-4259. PMid:1398936.
Ceplecha V, Svoboda M, Cepicka I, Husnik R, Horackova K, Svobodova V. InPouchTM TF-Feline medium is not specific for Tritrichomonas foetus. Vet Parasitol 2013; 196(3-4): 503-505. http://dx.doi.org/10.1016/j. vetpar.2013.04.015. PMid:23643452.
CeplechaV, SvobodovaV, Lendon C, Husnik R, Horackova K, Svoboda M. A survey of feline trichomonosis suggests a low incidence of Tritrichomonas blagburni among cats in the Czech Republic. Vet Med 2017; 62(5): 269- 273. http://dx.doi.org/10.17221/106/2016-VETMED.
Clothier KA, Villanueva M, Torain A, Hult C, Wallace R. Effects of bacterial contamination of media on the diagnosis of Tritrichomonas foetus by culture and real-time PCR. Vet Parasitol 2015; 208(3-4): 143- 149. http://dx.doi.org/10.1016/j.vetpar.2015.01.006. PMid:25639514.
Dąbrowska J, Karamon J, Kochanowski M, Jędryczko R, Cencek T. Tritrichomonas foetus infection in cat - first detection in Poland. Acta Parasitol 2015; 60(4): 605-608. http://dx.doi.org/10.1515/ap-2015- 0084. PMid:26408578.
DaCunha AM, Muniz J. Sobre um flagellado parasito do gato. Trab Inst Oswaldo Cruz 1922; 36: 285-286.
Dahlgren SS, Gjerde B, Pettersen HY. First record of natural Tritrichomonas foetus infection of the feline uterus. J Small Anim Pract 2007; 48(11): 654-657. http://dx.doi.org/10.1111/j.1748-5827.2007.00405.x. PMid:17725583.
Dimski DS. Helminth and noncoccidial protozoan parasites of the gastrointestinal tract. In: Sherding RG, editors. The Cat: Diseases and Clinical Management, 2nd ed. New York: Churchill Livingstone; 1989. p. 459-477.
Doi J, Hirota J, Morita A, Fukushima K, Kamijyo H, Ohta H, et al. Intestinal Tritrichomonas suis (=T. foetus) infection in Japanese cats. J Vet Med Sci 2012; 74(4): 413-417. http://dx.doi.org/10.1292/jvms.11- 0171. PMid:22104396.
Duarte RP, Rocha PRDA, Nakamura AA, Cipriano RS, Viol MA, Melo GD, et al. Detection of natural occurrence of Tritrichomonas foetus in cats in Araçatuba, São Paulo, Brazil. Pesq Vet Bras 2018; 38(2): 309-314. http://dx.doi.org/10.1590/1678-5150-pvb-5115.
Felleisen RS, Lambelet N, Bachmann P, Nicolet J, Muller N, Gottstein B. Detection of Tritrichomonas foetus by PCR and DNA enzyme immunoassay based on rRNA gene unit sequences. J Clin Microbiol 1998; 36(2): 513- 519. PMid:9466768.
Felleisen RS. Comparative sequence analysis of 5.8S rRNA genes and internal transcribed spacer (ITS) regions of trichomonadid protozoa. Parasitology 1997; 115(Pt 2): 111-119. http://dx.doi.org/10.1017/ S0031182097001212. PMid:10190167.
Felleisen RS. Host-parasite interaction in bovine infection with Tritrichomonas foetus. Microbes Infect 1999; 1(10): 807-816. http://dx.doi.org/10.1016/ S1286-4579(99)80083-5. PMid:10816086.
Foster DM, Gookin JL, Poore MF, Stebbins ME, Levy MG. Outcome of cats with diarrhea and Tritrichomonas foetus infection. J Am Vet Med Assoc 2004; 225(6): 888-892. http://dx.doi.org/10.2460/javma.2004.225.888. PMid:15485048.
Frey CF, Schild M, Hemphill A, Stünzi P, Müller N, Gottstein B, et al. Intestinal Tritrichomonas foetus infection in cats in Switzerland detected by in vitro cultivation and PCR. Parasitol Res 2009; 104(4): 783-788. http://dx.doi.org/10.1007/s00436-008-1255-2. PMid:18998166.
Gookin JL, Birkenheuer AJ, Breitschwerdt EB, Levy MG. Single-tube nested PCR for diagnosis of Tritrichomonas foetus in feline feces. J Vet Clin Microbiol 2002; 40(11): 4126-4130. http://dx.doi.org/10.1128/ JCM.40.11.4126-4130.2002. PMid:12409385.
Gookin JL, Birkenheuer AJ, St John V, Spector M, Levy MG. Molecular characterization of trichomonads from feces of dogs with diarrhea. J Parasitol 2005; 91(4): 939-943. http://dx.doi.org/10.1645/GE-474R.1. PMid:17089769.
Gookin JL, Breitschwerdt EB, Levy MG, Gager RB, Benrud JG. Diarrhea associated with trichomonosis in cats. J Am Vet Med Assoc 1999; 215(10): 1450-1454. PMid:10579040.
Gookin JL, Copple CN, Papich MG, Poore MF, Stauffer SH, Birkenheuer AJ, et al. Efficacy of ronidazole for treatment of feline Tritrichomonas foetus infection. J Vet Intern Med 2006; 20(3): 536-543. http://dx.doi. org/10.1111/j.1939-1676.2006.tb02893.x. PMid:16734086.
Gookin JL, Foster DM, Poore MF, Stebbins ME, Levy MG. Use of a commercially available culture system for diagnosis of Tritrichomonas foetus infection in cats. J Am Vet Med Assoc 2003; 222(10): 1376-1379. http://dx.doi.org/10.2460/javma.2003.222.1376. PMid:12762381.
Gookin JL, Hanrahan K, Levy MG. The conundrum of feline trichomonosis. J Feline Med Surg 2017; 19(3): 261-274. http://dx.doi. org/10.1177/1098612X17693499. PMid:28245739.
Gookin JL, Levy MG, Law JM, Papich MG, Poore MF, Breitschwerdt EB. Experimental infection of cats with Tritrichomonas foetus. Am J Vet Res 2001; 62(11): 1690-1697. http://dx.doi.org/10.2460/ajvr.2001.62.1690. PMid:11703009.
Gookin JL, Stauffer SH, Coccaro MR, Poore MF, Levy MG, Papich MG. Efficacy of tinidazole for treatment of cats experimentally infected with Tritrichomonas foetus. Am J Vet Res 2007; 68(10): 1085-1088. http:// dx.doi.org/10.2460/ajvr.68.10.1085. PMid:17916015.
Gookin JL, Stebbins ME, Hunt E, Burlone K, Fulton M, Hochel R, et al. Prevalence of and risk factors for feline Tritrichomonas foetus and Giardia infection. J Clin Microbiol 2004; 42(6): 2707-2710. http://dx.doi. org/10.1128/JCM.42.6.2707-2710.2004. PMid:15184456.
Gookin JL, Stone MR, Yaeger MJ, Meyerholz DK, Moisan P. Fluorescence in situ hybridization for identification of Tritrichomonas foetus in formalin-fixed and paraffin-embedded histological specimens of intestinal trichomoniasis. Vet Parasitol 2010; 172(1-2): 139-143. http://dx.doi. org/10.1016/j.vetpar.2010.04.014. PMid:20447769.
Grahn RA, BonDurant RH, van Hoosear KA, Walker RL, Lyons LA. An improved molecular assay for Tritrichomonas foetus. Vet Parasitol 2005; 127(1): 33-41. http://dx.doi.org/10.1016/j.vetpar.2004.08.018. PMid:15619373.
Gray SG, Hunter AS, Stone MR, Gookin JL. Assessment of reproductive tract disease in cats at risk for Tritrichomonas foetus infection. Am J Vet Res 2010; 71(1): 76-81. http://dx.doi.org/10.2460/ajvr.71.1.76. PMid:20043785.
Gunn-Moore DA, McCann TM, Reed N, Simpson KE, Tennant B. Prevalence of Tritrichomonas foetus infection in cats with diarrhoea in the UK. J Feline Med Surg 2007; 9(3): 214-218. http://dx.doi.org/10.1016/j. jfms.2007.01.003. PMid:17446107.
Gunn-Moore DA, Tennant B. Tritrichomonas foetus diarrhoea in cats. Vet Rec 2007; 160(24): 850-851. http://dx.doi.org/10.1136/vr.160.24.850-b. PMid:17575251.
Hale S, Norris JM, Slapeta J. Prolonged resilience of Tritrichomonas foetus in cat faeces at ambient temperature. Vet Parasitol 2009; 166(1-2): 60- 65. http://dx.doi.org/10.1016/j.vetpar.2009.07.032. PMid:19683398.
Ho MS, Conrad PA, Conrad PJ, LeFebvre RB, Perez E, BonDurant RH. BonDurant RH. Detection of bovine trichomoniasis with a specific DNA probe and PCR amplification system. J Clin Microbiol 1994; 32(1): 98-104. PMid:8126211.
Holliday M, Deni D, Gunn-Moore DA. Tritrichomonas foetus infection in cats with diarrhoea in a rescue colony in Italy. J Feline Med Surg 2009; 11(2): 131-134. http://dx.doi.org/10.1016/j.jfms.2008.06.004. PMid:18774326.
Hora AS, Miyashiro SI, Cassiano FC, Brandão PE, Reche-Junior A, Pena HFJ. Report of the first clinical case of intestinal trichomoniasis caused by Tritrichomonas foetus in a cat with chronic diarrhoea in Brazil. BMC Vet Res 2017; 13(1): 109. ttp://dx.doi.org/10.1186/s12917-017-1026- 3. Mid:28412947.
Hosein A, Kruth AS, Pearl DL, Richardson D, Maggs JC, Peach HA, et al. Isolation of Tritrichomonas foetus from cats sampled at a cat clinic, cat shows and a humane society in southern Ontario. J Feline Med Surg 2013; 15(8): 706-711. http://dx.doi.org/10.1177/1098612X13475617. PMid:23362340.
Jordan HE. Trichomonas spp. in feline: a case report. Vet Med 1956; 51: 23-24.
Kather EJ, Marks SL, Kass PH. Determination of the in vitro susceptibility of feline Tritrichomonas foetus to 5 Antimicrobial agents. J Vet Intern Med 2007; 21(5): 966-970. http://dx.doi.org/10.1111/j.1939-1676.2007. tb03050.x. PMid:17939550.
Kessel JF. Trichomoniasis in kittens. Trans R Soc Trop Med Hyg 1928; 22(1): 61-80. http://dx.doi.org/10.1016/S0035-9203(28)90155-8.
Kingsbury DD, Marks SL, Cave NJ, Grahn RA. Identification of Tritrichomonas foetus and Giardia spp. infection in pedigree show cats in New Zealand. N Z Vet J 2010; 58(1): 6-10. http://dx.doi.org/10.10 80/00480169.2010.65054. PMid:20200569.
Klein B, Langbein-Detsch I, Muller E, Heusinger A. Prävalenz von Tritrichomonas foetus in Kotproben von Katzen mit Durchfall aus Deutschland. Kleintiermedizin 2010; 7/8: 243-247.
Köster LS, Chow C, Yao C. Trichomonosis in cats with diarrhoea in Hong Kong, China, between 2009 and 2014. JFMS Open Rep 2015; 1(2): 2055116915623561. PMid:28491403.
Kuehner KA, Marks SL, Kass PH, Sauter-Louis C, Grahn RA, Barutzki D, et al. Tritrichomonas foetus infection in purebred cats in Germany: prevalence of clinical signs and the role of co-infection with other enteroparasites. J Feline Med Surg 2011; 13(4): 251-258. http://dx.doi. org/10.1016/j.jfms.2010.12.002. PMid:21288749.
LeVine DN, Papich MG, Gookin JL, Davidson GS, Davis JL, Hayes RB. Ronidazole pharmacokinetics after intravenous and oral immediate-release capsule administration in healthy cats. J Feline Med Surg 2011; 13(4): 244-250. http://dx.doi.org/10.1016/j.jfms.2010.12.001. PMid:21239199.
LeVine DN. Veterinary Protozoology, 1st ed. Ames: ISU Press; 1985.
Levy MG, Gookin JL, Poore M, Birkenheuer AJ, Dykstra MJ, Litaker RW. Tritrichomonas foetus and not Pentatrichomonas hominis is the etiologic agent of feline trichomonal diarrhea. J Parasitol 2003; 89(1): 99-104. http://dx.doi.org/10.1645/0022-3395(2003)089[0099:TFANPH]2.0. CO;2. PMid:12659310.
Lim S, Park SI, Ahn KS, Oh DS, Ryu JS, Shin SS. First report of feline intestinal trichomoniasis caused by Tritrichomonas foetus in Korea. Korean J Parasitol 2010; 48(3): 247-251. http://dx.doi.org/10.3347/ kjp.2010.48.3.247. PMid:20877505.
Lun ZR, Chen XG, Zhu XQ, Li XR, Xie MQ. Are Tritrichomonas foetus and Tritrichomonas suis synonyms? Trends Parasitol 2005; 21(3): 122-125. http://dx.doi.org/10.1016/j.pt.2004.12.001. PMid:15734659.
Mancianti F, Nardoni S, Mugnaini L, Zambernardi L, Guerrini A, Gazzola V, et al. A retrospective molecular study of select intestinal protozoa in healthy pet cats from Italy. J Feline Med Surg 2015; 17(2): 163-167. http:// dx.doi.org/10.1177/1098612X14533549. PMid:24793744.
Mardell EJ, Sparkes AH. Chronic diarrhoea associated with Tritrichomonas foetus infection in a British cat. Vet Rec 2006; 158(22): 765-766. http:// dx.doi.org/10.1136/vr.158.22.765. PMid:16751313.
Miró G, Hernández L, Montoya A, Arranz-Solís D, Dado D, Rojo-Montejo S, et al. First description of naturally acquired Tritrichomonas foetus infection in a Persian cattery in Spain. Parasitol Res 2011; 109(4): 1151- 1154. http://dx.doi.org/10.1007/s00436-011-2359-7. PMid:21509446.
Morin-Adeline V, Lomas R, O’Meally D, Stack C, Conesa A, Šlapeta J. Comparative transcriptomics reveals striking similarities between the bovine and feline isolates of Tritrichomonas foetus: consequences for in silico drug-target identification. BMC Genomics 2014; 15(1): 955. http:// dx.doi.org/10.1186/1471-2164-15-955. PMid:25374366.
Mostegl MM, Wetscher A, Richter B, Nedorost N, Dinhopl N, Weissenbock H. Detection of Tritrichomonas foetus and Pentatrichomonas hominis in intestinal tissue specimens of cats by chromogenic in situ hybridization. Vet Parasitol 2012; 183(3-4): 209-214. http://dx.doi.org/10.1016/j. vetpar.2011.07.050. PMid:21856079.
Mugnaini L, Papini R, Gorini G, Passantino A, Merildi V, Mancianti F. Pattern and predictive factors of endoparasitism in cats in Central Italy. Rev Med Vet 2012; 163(2): 89-94.
Paris JK, Wills S, Balzer HJ, Shaw D, Gunn-Moore D. Enteropathogen co-infection in UK cats with diarrhoea. BMC Vet Res 2014; 10(1): 13. http://dx.doi.org/10.1186/1746-6148-10-13. PMid:24410914.
Pereira-Neves A, Benchimol M. Tritrichomonas foetus: budding from multinucleated pseudocysts. Protist 2009; 160(4): 536-551. http://dx.doi.org/10.1016/j.protis.2009.05.001. PMid:19616999.
Pereira-Neves A, Ribeiro KC, Benchimol M. Pseudocysts in trichomonads - new insights. Protist 2003; 154(3-4): 313-329. http://dx.doi. org/10.1078/143446103322454095. PMid:14658492.
Pham D. Chronic intermittent diarrhea in a 14-month-old Abyssinian cat. Can Vet J 2009; 50(1): 85-87. PMid:19337620.
Polak KC, Levy JK, Crawford PC, LeuteneggerCM, Moriello KA. Infectious diseases in large-scale cat hoarding investigations. Vet J 2014; 201(2): 189-195. http://dx.doi.org/10.1016/j.tvjl.2014.05.020. PMid:24934262.
Profizi C, Cian A, Meloni D, Hugonnard M, Lambert V, Groud K, et al. Prevalence of Tritrichomonas foetus infections in French catteries. Vet Parasitol 2013; 196(1-2): 50-55. http://dx.doi.org/10.1016/j.vetpar.2013.01.021. PMid:23433647.
Queen EV, Marks SL, Farver TB. Prevalence of selected bacterial and parasitic agents in feces from diarrheic and healthy control cats from Northern California. J Vet Intern Med 2012; 26(1): 54-60. http://dx.doi. org/10.1111/j.1939-1676.2011.00843.x. PMid:22182203.
Raab O, Greenwood S, Vanderstichel R, Gelens H. A cross-sectional study of Tritrichomonas foetus infection in feral and shelter cats in Prince Edward Island, Canada. Can Vet J 2016; 57(3): 265-270. PMid:26933262.
Romatowski J. An uncommon protozoan parasite (Pentatrichomonas hominis) associated with colitis in three cats. Feline Pract 1996; 24(5): 10-14.
Romatowski J. Pentatrichomonas hominis infection in four kittens. J Am Vet Med Assoc 2000; 216(8): 1270-1272. http://dx.doi.org/10.2460/ javma.2000.216.1270. PMid:10767968.
Rosa IA, Souza W, Benchimol M. Changes in the structural organization of the cytoskeleton of Tritrichomonas foetus during trophozoite-pseudocyst transformation. Micron 2015; 73: 28-35. http://dx.doi.org/10.1016/j. micron.2015.03.008. PMid:25880467.
Rosado TW, Specht A, Marks SL. Neurotoxicosis in 4 cats receiving ronidazole. J Vet Intern Med 2007; 21(2): 328-331. http://dx.doi. org/10.1111/j.1939-1676.2007.tb02968.x. PMid:17427396.
Santos CS, Jesus VL, McIntosh D, Berto BP, Lopes CWG. Co-infection by Tritrichomonas foetus and Pentatrichomonas hominis in asymptomatic cats. Pesq Vet Bras 2015; 35(12): 980-988. http://dx.doi.org/10.1590/ S0100-736X2015001200007.
Schrey C, Mundhenk L, Gruber A, Henning K, Frey C. Tritrichomonas foetus as a cause of diarrhoea in three cats. Kleintierpraxis 2009; 54(2): 93-96.
Skirrow S, BonDurant R, Farley J, Correa J. Efficacy of ipronidazole against trichomoniasis in beef bulls. J Am Vet Med Assoc 1985; 187(4): 405-407. PMid:4030475.
Slapeta J, Craig S, McDonell D, Emery D. Tritrichomonas foetus from domestic cats and cattle are genetically distinct. Exp Parasitol 2010; 126(2): 209-213. http://dx.doi.org/10.1016/j.exppara.2010.04.024. PMid:20438726.
Stauffer SH, Birkenheuer AJ, Levy MG, Marr H, Gookin JL. Evaluation of four DNA extraction methods for the detection of Tritrichomonas foetus in feline stool specimens by polymerase chain reaction. J Vet Diagn Invest 2008; 20(5): 639-641. http://dx.doi.org/10.1177/104063870802000518. PMid:18776100.
Steiner JM, Xenoulis PG, Read SA, Suchodolski JS, Globokar M, Huisinga E, et al. Identification of Tritrichomonas foetus DNA in feces from cats with diarrhea from Germany and Austria. J Vet Intern Med 2007; 21(3): 649.
Stockdale H, Rodning S, Givens M, Carpenter D, Lenz S, Spencer J, et al. Experimental infection of cattle with a feline isolate of Tritrichomonas foetus. J Parasitol 2007; 93(6): 1429-1434. http://dx.doi.org/10.1645/ GE-1305.1. PMid:18314690.
Stockdale HD, Dillon AR, Newton JC, Bird RC, Bondurant RH, Deinnocentes P, et al. Experimental infection of cats (Felis catus) with Tritrichomonas foetus isolated from cattle. Vet Parasitol 2008; 154(1-2): 156-161. http://dx.doi.org/10.1016/j.vetpar.2008.02.024. PMid:18394809.
Stockdale HD, Givens MD, Dykstra CC, Blagburn BL. Tritrichomonas foetus infections in surveyed pet cats. Vet Parasitol 2009; 160(1-2): 13- 17. http://dx.doi.org/10.1016/j.vetpar.2008.10.091. PMid:19070434.
Stockdale HD, Spencer JA, Dykstra CC, Blagburn BL, West GS, Hankes T, et al. Feline trichomoniasis: an emerging disease? Compend Contin Educ Vet 2006; 28(6): 463-471.
Sun Z, Stack C, Slapeta J. Sequence differences in the diagnostic region of the cysteine protease 8 gene of Tritrichomonas foetus parasites of cats and cattle. Vet Parasitol 2012; 186(3-4): 445-449. http://dx.doi.org/10.1016/j. vetpar.2011.12.001. PMid:22204891.
Tachezy J, Tachezy R, Hampl V, Sedinová M, Vanacová S, Vrlík M, et al. Cattle pathogen Tritrichomonas foetus (Riedmuller, 1928) and pig commensal Tritrichomonas suis (Gruby & Delafond, 1843) belong to the same species. J Eukaryot Microbiol 2002; 49(2): 154-163. http:// dx.doi.org/10.1111/j.1550-7408.2002.tb00360.x. PMid:12046599.
Tanabe M. Morphological studies on trichomonas. J Parasitol 1926; 12(3): 120-130. http://dx.doi.org/10.2307/3271220.
Tolbert MK, Gookin JL. Mechanisms of Tritrichomonas foetus Pathogenicity in Cats with Insights from Venereal Trichomonosis. J Vet Intern Med 2016; 30(2): 516-526. http://dx.doi.org/10.1111/jvim.13920. PMid:26946069.
Tolbert MK, Gookin JL. Tritrichomonas foetus: A new agent of feline diarrhea. Compend Contin Educ Vet 2009; 31(8): 374-381, 390, quiz 381. PMid:19866444.
Tysnes K, Gjerde B, Nodtvedt A, Skancke E. A cross-sectional study of Tritrichomonas foetus infection among healthy cats at shows in Norway. Acta Vet Scand 2011; 53(1): 39. http://dx.doi.org/10.1186/1751-0147- 53-39. PMid:21689400.
Van der Saag M, McDonell D, Slapeta J. Cat genotype Tritrichomonas foetus survives passage through the alimentary tract of two common slug species. Vet Parasitol 2010; 177(3-4): 262-266. http://dx.doi.org/10.1016/j. vetpar.2010.11.054. PMid:21185122.
van Doorn DC, De Bruin MJ, Jorritsma RA, Ploeger HW, Schoormans A. Prevalence of Tritrichomonas foetus among Dutch cats. Tijdschr Diergeneeskd 2009; 134(17): 698-700. PMid:19774881.
Vermeulen BD. Tritrichomonas foetus in young cats with chronic diarrhoea: Comparison of different diagnostic methods [PhD Thesis]. Utrecht: Utrecht University; 2009.
Veronesi F, Gazzonis AL, Napoli E, Brianti E, Santoro A, Zanzani SA, et al. Cross-sectional survey on Tritrichomonas foetus infection in Italian cats. Vet Parasitol Reg Stud Rep 2016; 6: 14-19.
Walden HS, Dykstra C, Dillon A, Rodning S, Givens D, Bird R, et al. A new species of Tritrichomonas (Sarcomastigophora: Trichomonida) from the domestic cat (Felis catus). Parasitol Res 2013; 112(6): 2227- 2235. http://dx.doi.org/10.1007/s00436-013-3381-8. PMid:23525691.
Warton̄a A, Honigberg BM. Structure of trichomonads as revealed by scanning electron microscopy. J Protozool 1979; 26(1): 56-62. http:// dx.doi.org/10.1111/j.1550-7408.1979.tb02732.x. PMid:314517.
Xenoulis PG, Lopinski DJ, Read SA, Suchodolski JS, Steiner JM. Intestinal Tritrichomonas foetus infection in cats: a retrospective study of 104 cases. J Feline Med Surg 2013; 15(12): 1098-1103. http://dx.doi. org/10.1177/1098612X13495024. PMid:23838083.
Xenoulis PG, Saridomichelakis MN, Read SA, Suchodolski JS, Steiner JM. Detection of Tritrichomonas foetus in cats in Greece. J Feline Med Surg 2010; 12(10): 831-833. http://dx.doi.org/10.1016/j.jfms.2010.05.010. PMid:20674428.
Yaeger MJ, Gookin JL. Histologic features associated with Tritrichomonas foetus induced colitis in domestic cats. Vet Pathol 2005; 42(6): 797-804. http://dx.doi.org/10.1354/vp.42-6-797. PMid:16301576.
YaoC, Koster L, Halper B, DundasJ, Nair R. Failure to detect Tritrichomonas foetus in a cross-sectional survey in the populations of feral cats and owned outpatient cats on St Kitts, West Indies. JFMS Open Rep 2018; 4(1); 1-6. PMid:30202541.
Yao C, Koster LS. Tritrichomonas foetus infection, a cause of chronic diarrhea in the domestic cat. Vet Res 2015; 46(1): 35. http://dx.doi. org/10.1186/s13567-015-0169-0. PMid:25880025.
Zanzani SA, Gazzonis AL, Scarpa P, Olivieri E, Balzer HJ, Manfredi MT. Coinfection with Tritrichomonas foetus and Giardia duodenalis in Two Cats with Chronic Diarrhea. Case Rep Vet Med. 2016 Sep 6;2016:5705168. doi: 10.1155/2016/5705168. PMID: 29955418; PMCID: PMC6005279
Источник: What is known about Tritrichomonas foetus infection in cats? Bastos BF, Almeida FM, Brener B. Rev Bras Parasitol Vet. 2019 Jan-Mar;28(1):1-11. doi: 10.1590/S1984-29612019005. Epub 2019 Mar 11. PMID: 30892464
